已知A、B、C、D均是元素周期表中前36号中的元素,其原于序数依次递增,其他相关结构或性质信息如下表。
| 元素 |
结构或性质信息 |
| A |
原子核外有一个未成对电子,其氢化物与水分子间能形成氢键 |
| B |
原子核外M层电子数是N层电子数的4倍 |
| C |
是使用最为广泛的合金的主要成分 |
| D |
原子各内层电子均已饱和,最外层电子数为1 |
请根据信息回答有关问题:
(1)C元素在周期表中的位置为____ ,D元素原子的外围电子排布式为
(2)用氢键表示式写出A的氢化物水溶液中存在的所有氢键____ 。
(3)A与氧可形成原子个数比为2:1的三原子分子,其中氧的化合价为____ ,氧原子杂化类型与下列分子的中心原子杂化类型相同的是____
a:CO2 b:SO2 c:NH3 d;CH4
(4)A、B可形成离子化合物,其晶胞结构如下图甲所示,则晶胞中B离子的个数为____ ,与B离子最近且等距的A离子的个数为 。
(5)1183 K以下C晶体的晶胞如图乙中图1,而1183 K以上则转变为图2,在两种晶胞中最邻近的C原子间距离相同,则图1、图2所示两种晶中原子的空间利用率之比为___ _(可用根号表示)。
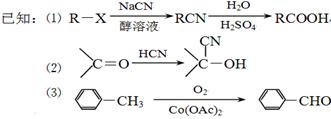
现用如下方法合成高效、低毒农药杀灭菊酯 ( ) :
) :

(1)B的结构简式是_____________;合成G的反应类型是__________。
(2)有关A的下列说法正确的是__________(填序号)。
a.A与苯互为同系物
b.A的核磁共振氢谱有5个峰
c.充分燃烧等物质的量A和环己烷消耗氧气的量相等
d.A的所有原子可能处在同一平面上
e.A不能使酸性KMnO4溶液褪色
(3)写出反应 F+I→杀灭菊酯的化学方程式:___________________。
(4)写出C在高温高压、催化剂条件下与足量氢氧化钠水溶液充分反应的化学方程式:
______________
(5)D在硫酸存在下发生水解生成J:D  J,写出符合下列要求的J的所有同分异构体的结构简式:___________________。
J,写出符合下列要求的J的所有同分异构体的结构简式:___________________。
①苯环上有两个位于间位的取代基;②能水解成两种有机物;③可以银镜反应。
(6)X与F互为同分异构体,X苯环上有三个取代基且含有 结构,则符合此条件的X共有种。
结构,则符合此条件的X共有种。
已知A、B、C、D、M、W六种元素的原子序数依次递增,都位于前四周期。其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且S轨道电子数是P轨道电子数的两倍;C原子L层上有2对成对电子。M和W均有“生物金属”之称,M4+离子和氩原子的核外电子排布相同;W处于周期表中第8列。请回答下列问题:
(1)l mol B2A2分子中含σ键的数目是。
(2)BC 2在高温高压下所形成的晶体其晶胞(晶体中最基本的重复单元)如图所示。则该晶体的类型属于晶体(选填“分子”、“原子”、“离子”或“金属”);该晶体中B原子轨道的杂化类型为。
(3)“生物金属”M内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图。若该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,M原子的摩尔质量为Mr g/mol,则该晶胞的“边长”为cm。
(4)“生物金属”W元素应用广泛,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。
①W元素基态原子价电子排布式为。
②CN—与(一种单质分子)互为等电子体。
(5)光谱证实单质D与强碱溶液反应有[D(OH)4]—生成,则[D(OH)4]—中存在。
a.极性键 b.配位键 c.σ键 d.π键
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下: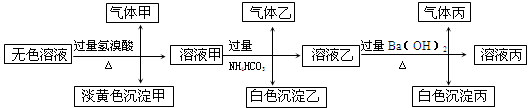
回答下列问题:
(1)生成沉淀甲的离子方程式:;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 |
实验目的 |
试剂 |
现象 |
| 1 |
|||
| 2 |
|||
| 3 |
|||
| 4 |
(2)由溶液甲生成沉淀乙的离子方程式:;
(3)综上所述,该溶液中肯定存在的离子有:。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是。
2012年始,雾霾天气无数次肆虐家乡邯郸。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:Ⅰ CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
Ⅱ 2NO2(g) N2O4(g)△H=-56.9 kJ/mol
N2O4(g)△H=-56.9 kJ/mol
Ⅲ H2O(g) = H2O(l)ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①甲烷燃料电池的负极反应式:。
②电解后溶液的pH=(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是L
根据要求填空:
(1)只用键线来表示碳架,两根单键之间或一根双键和一根单键之间的夹角为120˚,一根单键和一根三键之间的夹角为180˚,而分子中的碳氢键、碳原子及与碳原子相连的氢原子均省略,而其他杂原子及与杂原子相连的氢原子须保留。每个端点和拐角处都代表一个碳。用这种方式表示的结构式为键线式。写出下列有机物的键线式:
①CH3(CH2)2COOH____________________;②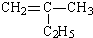 :__________________。
:__________________。
(2)写出下列原子团的电子式:①甲基 _______________;②氢氧根离子 _____________
(3)写出有机物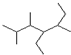 的名称 _______________________________________
的名称 _______________________________________
(4)在有机物分子中若某一个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”.C7H16的同分异构体中具有“手性碳原子”的有 ___________种.
(5)某有机高分子化合物的结构片段如下: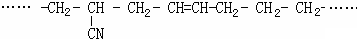
则合成它的单体是 ____________________________________。