煤的气化是高效、清洁地利用煤炭的重要途径之一。
(1)在250C 101kPa时,H2与O2化合生成1mol H2O(g)放出241.8kJ的热量,其热化学方程式为
___________
又知: ①C(s)+O2(g)═CO2(g) △H=-393.5kJ/mol
②CO(g)+ O2(g)═CO2(g) △H=-283.0kJ/mol
O2(g)═CO2(g) △H=-283.0kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)═CO(g)+H2(g) △H=____kJ/mol
(2) CO可以与H2O(g)进一步发生反应: CO(g)+H2O(g) CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
(3) 工业上从煤气化后的混合物中分离出H2,进行氨的合成,已知反应反应N2(g)+3H2(g 2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
①N2的平均反应速率v1(N2)、vII(N2)、vIII(N2)从大到小排列次序为________;
②由第一次平衡到第二次平衡,平衡移动的方向 是________,采取的措施是________。
③比较第II阶段反应温度(T2)和第III阶段反应速度(T3)的高低:T2________T3填“〉、=、<”判断的理由是________________。
(12分)某化学兴趣小组需100 mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为。
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品,放入烧杯内
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
(2)回答下列问题:
①将样品溶于稀H2SO4,而不直接溶于水的理由是。
②上述配制过程中,除使用烧杯、量筒外,必不可少的玻璃仪器还有
Ⅱ.标定FeSO4溶液的浓度
(1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.1000 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,据此可测得FeSO4溶液的物质的量浓度为______。
(2)滴定时选用____ (A.石蕊B.酚酞C.不用指示剂,填序号)为指示剂,选用的理由是。
(8分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g) 2NO2(g),下列各项能说明反应达到平衡状态的是。
2NO2(g),下列各项能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1 molO2同时生成2 molNO2
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 |
CO |
H2 |
CH3OH |
| 浓度(mol•L—1) |
0.9 |
1.0 |
0.6 |
①列式并计算平衡常数K=__________________________。
②若降低温度,K值增大,则反应的△H0(填“>”或“<”)。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)
(1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0 kJ。写出该反应的热化学方程式。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18g液态水,并放出515kJ热量,则CH4的物质的量为。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入甲烷和氧气。通入甲烷气体的电极应为极(填写“正”或“负”),该电极上发生的电极反应式为。
(3)在下图所示实验装置中总反应的方程式为;
如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是;
若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入(填物质名称),其质量约为。
(6分)(1)硫化钠水溶液显碱性的原因_______________(用离子方程式表示)
(2)用硫化亚铁作沉淀剂除去污水中的Cu2+_______________________
(3)浑浊的石灰水中存在的溶解平衡________________
(10分)现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。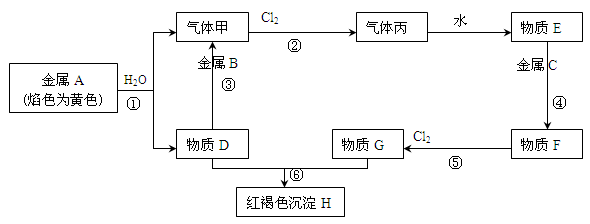
请回答下列问题:
(1)写出下列物质的化学式:B、丙
(2)写出下列反应的化学方程式:
反应①;
反应③;
反应⑥。