盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表达不正确的是
| A.在NaHCO3溶液中加入与其等物质的量的NaOH ,溶液中的阴离子只有CO32-和OH- |
| B.NaHCO3溶液中:c(HCO3- ) +c(H2CO3) +c(CO32-)=c(Na+) |
| C.相同温度下,l0mL 0.lmol·L-1的醋酸与100mL 0.01 mol·L-1的醋酸中H+的物质的量不相等 |
| D.相同温度下,中和体积与pH都相同的HCI溶液和CH3COOH溶液所消耗的NaOH的物质的量,后者多 |
关于下图所示装置的叙述,正确的是( )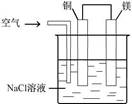
| A.该装置没有电流产生 |
| B.铜片质量逐渐减少 |
| C.镁片为负极,电极反应为Mg-2e—====Mg2+ |
| D.铜片为正极,铜片上有无色气泡产生 |
在所给条件下下列各组离子能够大量共存的是
| A.pH =0的无色溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B.使甲基橙变红的溶液中:Na+、HCO3-、Cl-、NO3- |
| C.在有大量MnO4-溶液中:K+、Fe2+、SO42-、Cl- |
| D.投入Al有氢所放出的溶液中:Na+、Cl-、K+、SO42- |
常温常压下,充分燃烧一定量的甲烷放出热量222.575KJ,经测定完全吸收生成的二氧化碳需消耗1mol/L的NaOH溶液250mL,恰好生成正盐。则此条件下甲烷的燃烧热热化学方程式 ( )
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H="-890.3" kJ/mol |
| B.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l);△H="-222.575" kJ/mol |
| C.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(g);△H="-445.15" kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H="-890.3" kJ/mol |
NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A.常温常压下,22.4L的D2、H2组成的气体分子数为NA |
| B.pH=1的甲酸溶液中,HCOO-和OH-数目之和为0.1NA |
| C.SiO2晶体中,有NA个Si就有2NA个Si—O键 |
| D.9.6g铜与足量的稀硝酸反应,生成NO分子数一定为0.1NA |
下列反应的离子方程式书写正确的是()
| A.Fe2O3溶于过量的氢碘酸中 Fe2O3 +6H+ =2Fe3+ + 3H2O |
B.以石墨作电极电解氯化镁溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O |
| D.氨水中通入过量二氧化硫:2NH3•H2O + SO2 = 2NH4+ +SO32- +H2O |