镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:
请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是 。
(2)步骤2的离子方程式为 。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到 。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_ ,生产这种沉淀剂的方法是 。
表1试剂价格
| 试剂 |
KOH |
NaOH |
Ca(OH)2 |
| 价格(元/吨) |
6800 |
3200 |
1200 |
(3)步骤3如何实现?两位同学设计下列方案: 
这两种方案是否合理?请你评价:
方案一: 。
方案二: 。
你的设计方案是什么?写出流程图:
。
(1)二甲苯苯环上的一溴代物有六种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别为:
| 一溴代二甲苯 |
234℃ |
206℃ |
213.8℃ |
204℃ |
214.5℃ |
205 |
| 对应的二甲苯 |
-13℃ |
-54℃ |
-27℃ |
-54℃ |
-27℃ |
-54℃ |
熔点为234℃分子的结构简式为____________
(2)完全燃烧下列烃①丙烷(C3H8)、②丁烯(C4H8)、③乙烯(C2H4)、④己烷(C6H14),等物质的量的上述四种烃,耗氧量最小的为(填写序号);等质量时,则耗氧量最大的为(填写序号)。
(3)0.2 mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
① 若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
② 若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是________________。
(4)组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链。它完全燃烧时所消耗O2的体积是同状况下该烃蒸气体积的8.5倍,由此分析回答:
①若该烃为链状二烯烃,并且与等物质的量的Br2加成后只能得到单一产物,则该烃的结构简式为______________________________________
②若该烃只能与等物质的量的Br2发生加成反应,则其结构简式为______________(填任一种)。
吗啡和海洛因都是严格查禁的毒品。吗啡分子中C、H、N、O的质量分数分别为71.58%、6.67%、4.91%和16.84%,已知其相对分子质量不超过300。
求:(1)一个吗啡分子中含_________个氮原子
(2)吗啡的相对分子质量___________
(3)吗啡的化学式_________________
A~G是几种烃的分子球棍模型(如图),据此回答下列问题: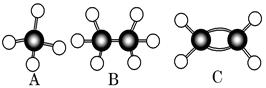
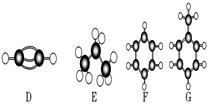
(1)常温下含碳量最高的气态烃是________(填字母)。
(2)能够发生加成反应的烃有________种。
(3)一卤代物种类最多的是________(填字母)。
(4)写出实验室制D的化学方程式_____________________________________________
(5)写出F发生硝化反应的化学方程式_________________________________________
乙烷和乙炔混合物共m mol,与n mol的氧气点燃后完全反应,得到CO和CO2的混合气体,以及36g水。试求:
(1)当m=0.8时,乙烷和乙炔的物质的量之比 。
(2)当m=1时,且反应后CO和CO2混合气体的物质的量是反应前氧气的物质的量的5/6时,则n=,得到的CO和CO2的物质的量之比 。
(3)m的取值范围是 ,n的取值范围是 。
优良的有机溶剂对孟烷的合成路线如下:
①已知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代。如: (R为烷基,X为卤素原子),
(R为烷基,X为卤素原子),
②RCH2CH2OH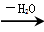 RCH=CH2
RCH=CH2
(1)B为芳香烃。
①由B生成对孟烷的反应类型是 。
②(CH3)2CHCl与A反应生成B的化学方程式是 。
(2)芳香族化合物C的分子式为C7H8O,其核磁共振氢谱有5种峰。E不能使Br2的CCl4溶液褪色。
①F的官能团是 。
②C的结构简式是 。
③反应I的化学方程式是 。
(3)下列说法正确的是 (填字母)。
A、B可使酸性高锰酸钾溶液褪色 B、A、B、F均为芳香族化合物
C、B和F互为同分异构体 D、E的沸点高于对孟烷