A、B、C、D是元素周期表前四周期常见的四种元素,原子序数依次增大, 它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
| 元素 |
相关结构和性质 |
| A |
A为非金属元素,其一种单质是电的良导体,难熔、质软并有润滑性,可用作电极材料 |
| B |
是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多 |
| C |
其单质既能与强酸溶液应又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小 |
| D |
D的高价氯化物的盐溶液常用于印刷电路极电路的“刻蚀” |
(1)D位于元素周期表第 周期第 族,其基态原子核外价电子排布式为 ;元素D的高价氯化物形成的盐溶液刻蚀印刷电路板电路所发生反应 的离子方程式为 ;
(2)钠与B元素形成的Na3B晶体属于 晶体(填“分子”、“原子”、“离子”)。 分析B元素的气态氢化物极易溶于水的原因,除了因为它们均是极性分子之外,还因为 ;
(3)元素A与元素B相比,非金属性较强的是 (用元素符号表示),可以作为判断两者非金属性强弱的依据的是 。
a.常温下A的单质和B的单质状态不同
b.该两种原子形成的共价键中共用电子对的偏向
c.最高价氧化物对应水化物的酸性强弱
d.单质与酸反应的难易程度
(4)已知毎5.4g元素C的单质可与元素D的低价氧化物反应,放出346.2kJ的热量。试写出该反应的热化学方程式: 。
在一定体积密闭容器中,进行如下反应: CO2(g
CO2(g ) + H2(g)
) + H2(g) CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1) K的表达式为:
(2) 该反应为 反应(“吸热”或“放热”)
(3) 能判断该反应是否达到化学平衡状态的依据
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4)在830℃时,若起始浓度c(CO)为1mol·L—1,c(H2O)为1mol·L—1,反应达到平衡时,CO的转化率为。
铅蓄电池是化学电源,它工作时的电池反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O。试回答:
(1)铅蓄电池正极的电极材料是__________。
(2)工作时该铅蓄电池负极的电极反应是__ ___________________________________。
(3)铅蓄电池工作时,电解质溶液的密度__________(填“减小”“增大”或“不变”,下同),pH__________。
(4)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,当制得0.05 mol Cl2时,在理论上电池内部消耗的H2SO4的物质的量是____________。
(1)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是。
(2)利用右装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应该置于处。若X为锌,开关K置于M 处,该电化学防护法称为。
处,该电化学防护法称为。
如图所示,若电解5 min 时铜电极质量增加2.16 g,试讨论:
时铜电极质量增加2.16 g,试讨论: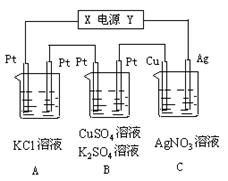
⑴电源电极X名称为_________。
⑵ pH变化:A_______,B______,C______。
⑶通过5 min时,B中共收集224 mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为______________。
⑷若A中KCl溶液的体积也是2 00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________
00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________ 。
。
2A B + C在某一温度时,达到平衡。
B + C在某一温度时,达到平衡。
(1)若温度升高,平衡向正反应方向移动,则正反应是_________反应(填放热或吸热);
(2)若B为固体,降低压强平衡 向逆反应方向移动,则A呈___________态;
向逆反应方向移动,则A呈___________态;
(3)若A是气态时,加压时,平衡不移动,则B为_________态,C为__________态;
(4) 若A、B、C均为气体,加入催化剂,平衡___________移动(填 正向、逆向、不)
正向、逆向、不)