如图所示,若电解5 min 时铜电极质量增加2.16 g,试讨论:
时铜电极质量增加2.16 g,试讨论: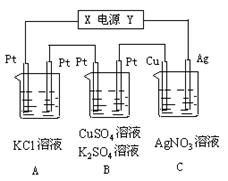
⑴电源电极X名称为_________。
⑵ pH变化:A_______,B______,C______。
⑶通过5 min时,B中共收集224 mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为______________。
⑷若A中KCl溶液的体积也是2 00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________
00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________ 。
。
材料与生活、生产息息相关,目前使用的材料主要有:金属材料、传统无机非金属材料、新型无机非金属材料、高分子材料、复合材料等。
(1)硅酸盐材料是重要的传统无机非金属材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一。下列不属于硅酸盐产品的是___________(填写序号)
①光导纤维②水泥③玻璃④陶瓷
(2) 玻璃是重要的建筑和装饰材料,玻璃属于____________(填“纯净物”或“混合物”)。有些玻璃的花纹是利用氢氟酸对普通玻璃中的二氧化硅的腐蚀作用而制成的,写出该反应的化学方程式_____________________________________
(3) 氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的__________反应;已知氮化硅中硅元素的化合价为+4价,则氮化硅的化学式为________________
(14分)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2 2NH3的平衡常数K值和温度的关系如下:
2NH3的平衡常数K值和温度的关系如下:
| 温度/℃ |
360 |
440 |
520 |
| K值 |
0.036 |
0.010 |
0.0038 |
(1)①由表中数据可知该反应为放热反应,理由是________________。
②理论上,为了增大平衡时H2的转化率,可采取的措施是______________(填字母序号)。
a增大压强 b使用合适的催化剂 c升高温度 d及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)  CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的 恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是p1________p2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3) 原料气H2还可通过反应CO(g)+H2O(g)  CO2(g)+H2 (g)获取。
CO2(g)+H2 (g)获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为________该温度下反应的平衡常数K值为________。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5 L的容器中进行反应,下列描述能够说明体系处于平衡状态的是____________(填字母序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
(12分)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)  2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
(1)该温度下,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是________________________________________________________________________。
(6分)25 ℃时,将体积为Va、pH=a的某一元酸与体积Vb、pH=b的某一元碱混合,请完成下题。
(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7。由此你能得到的结论是____________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00 mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11 mL。则b=________。
(3)若已知Va<Vb和a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是__________。
(8分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(按照要求用 a、 b 、c表示)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是______________。
(3)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是________________。
(4)若三者c(H+)相同时,物质的量浓度由大到小的顺序是________________。
(5)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是____________。
(6)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是_________
(7)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是_________________。