(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做一题。若两题都作答,则以A题计分。
A.《化学与生活》
(1)良好的生态环境可以提升生活质量。
①空气质量报告的各项指标可以反映出各地的空气质量。下列各项中目前未列入我国空气质量报告的是 (选填字母,下同)。
a.SO2
b.NO2
c.CO2
d.PM2.5
e.氯氟烃
②垃圾应分类收集。以下物质应放置于贴有“ ”标志垃圾筒的是 。
”标志垃圾筒的是 。
a.废电池 b.废铝制的易拉罐 c.建筑固弃物、渣土
③近日,公安机关成功破获了一起特大利用“地沟油”制售食用油案件。综合利用“地沟油”的一种方法,通常将“地沟油”进行简单加工提纯后,水解分离可获取 和 (填名称)。
(2)人体健康与食品、药物等关系密切。
①合理搭配饮食是我们的健康理念。比如早餐搭配:牛奶、面包、黄油、水果等,其中含有的营养素有油脂、糖类、 、 、无机盐和水。
②生活中应合理地摄取人体必需的元素,体内 元素含量过高或过低,会引起甲状腺疾病;当人体内缺钙时,可能患有的疾病是 。
a.贫血 b.骨质疏松 c.夜盲症
③氢氧化铝可以用来治疗胃酸过多,请写出该反应的离子方程式 。
④青霉素适合治疗的疾病是 。
a.感冒发烧 b.细菌感染 c.胃酸过多
(3)材料是人类赖以生存和发展的重要物质基础。
①在下列材料中,属于有机高分子材料的是 ;属于复合材料的是 。
a.硬币 b.聚氯乙烯塑料 c.氮化硅陶瓷 d.玻璃钢
②硅酸盐水泥是常用的建筑材料,它主要是以 和黏土为原料制成。
③钢铁在潮湿的空气中主要发生的电化学腐蚀是 腐蚀,通常用钝化、涂漆、电镀等方法来防止腐蚀。
B.《有机化学基础》
(1)有机化合物的制备、提纯和检验是有机化学研究的基础。
①实验室用乙醇和浓硫酸反应制备乙烯,应将反应温度控制在 (填字母。下同)左右。
a.140℃ b.170℃ c.100℃
②蛋白质提纯可用盐析法,下列盐溶液能用于蛋白质提纯的有 。
a.Na2SO4 b.AgNO3 c.CuCl2
③鉴别乙酸和甲酸甲酯,可采用的方法是 。
a.取样,滴加银氨溶液,水浴加热,观察是否有银镜生成
b.取样,加入乙醇,观察液体是否分层
c.取样,测定试样的核磁共振氢谱,观察谱图中吸收峰的个数
(2)某地近日自来水产生异味,原因是水源被苯酚污染。含苯酚的工业废水必须处理达标后才能排放,苯酚含量在1 g·L-1以上的工业废水应回收苯酚。某研究性学习小组设计下列流程,探究废水中苯酚的回收方法。
①可用 为试剂检验水样中是否含有苯酚。
②操作I的名称为 ,试剂a的化学式为 。
③通入CO2发生反应生成苯酚的化学方程式为 。
(3)某有机物的分子式为C3H6O3。
①1mol该有机物充分燃烧生成CO2和H2O,消耗O2在标准状况下的体积为 L。
②官能团决定有机物的化学性质。取等量的该有机物两份,分别与足量的碳酸氢钠和金属钠反应,生成的气体在同温同压下体积相等。该有机物含有的官能团为 、 (填名称),请写出该物质的一种结构简式 。
③若该有机物两分子间相互反应能生成含有六元环状结构的产物,写出该产物的结构简式 。
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
①CH4 (g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ΔH=-570 kJ·mol-1
②CH4(g)+4NO(g)="=2" N2(g) +CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
则CH4 (g)+2NO2(g)="=" N2(g)+CO2(g)+2H2O(g)ΔH=___________。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见下图:
①此反应为(填“放热”、“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池正极的电极反应式_______________________。
③在a MPa和一定温度下,将6 mol H2和2 mol CO2在2 L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即1/6),此时CO2的转化率是多少?(计算结果保留2位有效数字)
④在a MPa和500K下,将10mol H2和5 mol CO2在2 L密闭容器中混合,5min达到平衡,请在答题卡的坐标图中画出H2浓度变化图。(请标出相应的数据)
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 |
离子半径(pm) |
开始沉淀 时的pH |
完全沉淀 时的pH |
| Fe2+ |
74 |
7.6 |
9.7 |
| Fe3+ |
64 |
2.7 |
3.7 |
| Al3+ |
50 |
3.8 |
4.7 |
| Mn2+ |
80 |
8.3 |
9.8 |
| Pb2+ |
121 |
8.0 |
8.8 |
| Ca2+ |
99 |
- |
- |

请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式。
(2)氧化过程中主要反应的离子方程式。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是,应调节pH的范围为。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有、等;吸附步骤除去的主要离子为:。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:① H2(g)+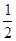 O2(g)=H2O(g)△H=-241.8kJ·mol-1
O2(g)=H2O(g)△H=-241.8kJ·mol-1
②C(s)+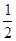 O2(g)=CO(g)△H=-110.5kJ·mol-1
O2(g)=CO(g)△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:。
(2)已知汽车汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H
2NO(g) △H 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
①在1300oC 时,该反应的平衡常数表达式K=。5s内该反应的平均速率ν(N2) = (保留2位有效数字);
②汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是。
(3)汽车尾气中NO和CO的转化。当催化剂质量一定时,增大催化剂固体的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g)+2CO(g) 2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的△H0 (填“>”或“<”)。
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注)。
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: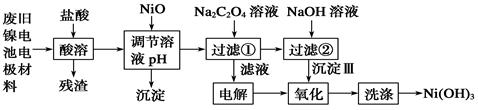
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。②K (Ni(OH)
(Ni(OH)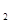 ): 5.0×10-16 ,K
): 5.0×10-16 ,K (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份(填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式,该反应的平衡常数为。
(5)沉淀Ⅲ可被电解所得产物之一(填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀?
。
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下:
已知:RCOOC2H5

请回答下列问题:
(1)A所含官能团的名称是________________, B的分子式为。
(2)B → C、E → F的反应类型分别为_____________、_____________。
(3)C → D的化学方程式为________________________________________________。
(4)写出同时满足下列条件的B的链状同分异构体的结构简式:_____________。
①核磁共振氢谱有2个吸收峰②能发生银镜反应
(5)试剂Y的结构简式为______________________。
(6)G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式:________________________。