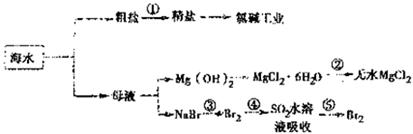
已知: (1)NH3(g)+HCl(g)=NH4Cl(s); △H1=-76kJ·mol-1
(2)NH3(g)+H2O(l)=NH3·H2O(aq); △H2=-35.1kJ·mol-1
(3)HCl(g)+HCl (aq); △H3=-72.3kJ·mol-1
(4)HCl (aq) NH3·H2O(aq) =NH4Cl(aq)+H2O(l); △H4=-52.3kJ·mol-1
(5)NH4Cl(s)=NH2Cl(aq); △H5=?
根据盖斯定律,则(5)方程式中的反应热△H5为
| A.-335.7 kJ·mol-1 | B.-16.3 kJ·mol-1 |
| C.+16.3 kJ·mol-1 | D.-83.7 kJ·mol-1 |
在25°C下,将,amol·L-1的醋酸(HAc)与0.01mol·L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na+)=c(Ac-)。则下列说法中,不正确的是()
A.此时醋酸和氢氧化钠溶液恰好中和 |
| B.反应平衡时溶液显中性 |
C.用含a的代数式表示醋酸(HAc)的电离常数 |
| D.a肯定大于0.01 |
下列叙述不正确的是()
A.天然气和沼气的主要成分都是甲醇,都属于非再生性能源
B.等物质的量的乙醇和乙烯完全燃烧时,所需氧气的质量相等
C.不用任何试剂即可鉴别四氯化碳和水两种无色液体
D.葡萄糖和蔗糖都含有C、H、O三 种元素,但不是同系物
种元素,但不是同系物
氮化硅(SiN4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2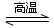 Si3N4+6CO。下列叙述正确的是()
Si3N4+6CO。下列叙述正确的是()
| A.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂 |
| B.上述反应中每生成1molSi3N4,N2得到12mol是电子 |
| C.若已知上述反应为放热反应,升高温度,其平衡常数增大 |
| D.若使压强增大,上述平衡向正反应方向移动 |
一定量某物质的溶液,其质量分数为0.2A,当加入等体积的水稀释后,其质量分数小于0.1A,则该溶液的密度( )
)
| A.大于水的密度 | B.小于水的密度 |
| C.等于水的密度 | D.无法确定 |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),根据下图海水综合利用的工业流程图,下列说法不正确的是()
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
B. 过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③、⑤中溴元素被氧化 |
D. 过程①中除去粗盐中的SO2-4、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 过程①中除去粗盐中的SO2-4、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |