元素锶(Sr)位于周期表第5周期第IIA族。碳酸锶(SrCO3)被广泛用于彩色电视机的阴极射线管。以天青石(主要成分为SrSO4,含不溶性杂质)为原料制取高纯碳酸锶的“煅烧浸取法”部分工艺流程示意如下。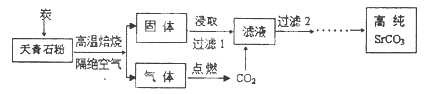
(1)写出与元素锶同族第3周期元素的原子结构示意图: 。
(2)隔绝空气高温焙烧中,若0.5mol SrSO4中只有S被还原,转移了4mol电子。写出该反应的化学方程式: 。
(3)制取高纯碳酸锶过程中,常用乙醇胺(HOCH2CH2NH2)作为CO2吸收剂。乙醇胺水溶液显弱碱性(与NH3溶于水原理相似),原因是 (用离子方程式表示)。
(4)该流程中过滤2之后还有除杂等多步操作,其中最后两步是 。
(5)“低温湿法”是一种制取碳酸锶的方法:将天青石粉末与碳酸钠溶液混合,70oC下加热1~2h后,经一系列操作,得到碳酸锶。主要反应为: SrSO4(s)+CO
SrSO4(s)+CO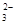 (aq) SrCO3(s)+SO
(aq) SrCO3(s)+SO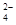 (aq)
(aq)
[已知:70oC时,Ksp(SrSO4)=3.3×10-7,Ksq(SrCO3)=1.1×10-10]
上述反应的平衡常数K= 。
(6)通过“低温湿法”得到的碳酸锶纯度较低,可能的原因是 (写一种)。
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下: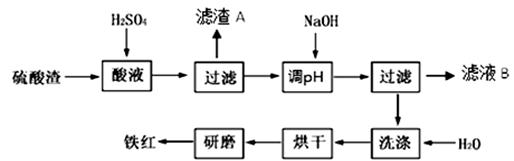
(1)硫酸渣的成分中既能与酸又能与碱反应的是,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式:。
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
| 完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
(3)滤渣A的主要成分为,滤液B含有的主要物质有。
(4)如何证明洗涤环节充分洗净。
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为。(用题中所给数据列式并用最简整数比表示结果)
(1)肼(N2H4)又称联氨,在常温下是一种液态燃料,可用作火箭燃料。已知在25℃时,101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量,表示N2H4燃烧热的热化学方程式是。
(2)肼-空气燃料电池是一种碱性燃料电池,肼-空气燃料电池放电时:正极的电极反应式:;负极的电极反应式:。
(3)下图是一个电解过程示意图。假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为16g,则肼-空气燃料电池理论上消耗标准状况下的空气L。(假设空气中氧气体积分数为20%)
以乙炔为原料通过以下流程能合成有机物中间体D.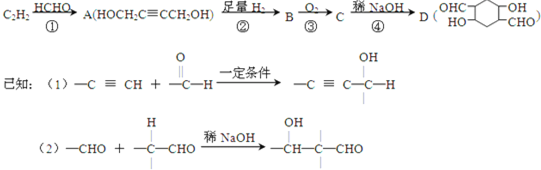
请回答下列问题:
(1)化合物D的分子式为,写出D中一种官能团的名称.
(2)写出生成A的化学反应方程式:.
(3)化合物B在浓硫酸催化下,加热与HOOCCOOH反应生成环状酯的化学方程式为(注明条件):
.
(4)化合物C的结构简式为:.
(5)已知1mol HCHO和1mol CH3CH2CHO发生类似已知(2)的反应,生成1molE.以下关于E的说法正确的是.
a、E能与H2发生加成反应,也能使酸性高锰酸钾溶液褪色.
b、E属于酯类物质.
c、1molE完全燃烧消耗5molO2.
d、生成E的反应属于取代反应.
有下列化学仪器:①托盘天平,②玻璃棒,③药匙,④烧杯,⑤量筒,⑥容量瓶,
⑦胶头滴管,⑧细口试剂瓶,⑨标签纸.
(1)现要配制500mL 1mol/L硫酸溶液,需用质量分数为98%、密度为1.84g/cm3的浓硫酸mL.
(2)从上述仪器中,按实验使用仪器的先后顺序.其编号排列是.
(3)若实验遇到下列情况,所配硫酸溶液的物质的量浓度偏小的有(填序号).
①用以稀释硫酸的烧杯未洗涤;
②未经冷却趁热将溶液注入容量瓶中;
③摇匀后发现液面低于刻度线再加水;
④容量瓶中原有少量蒸馏水;
⑤定容时仰视观察液面.
我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾.检验食盐中是否加碘,可利用如下反应:KIO3+KI+H2SO4═K2SO4+I2+H2O.
(1)将上述氧化还原反应的化学方程式配平.
(2)该反应中,氧化剂和还原剂的物质的量之比为.
(3)如果反应中转移0.2mol电子,则生成I2的物质的量为.
(4)利用上述反应检验食盐中是否加碘,所需试剂是(填序号).
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸 ⑤AgNO3溶液.