A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大。A原子无中子, B、G原子的最外层电子数均为其电子层数的两倍,D、G元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应(相对分子质量甲< 乙)转化关系如图(反应条件略去),原子E最外层电子数和其电子层数相等。元素F形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题: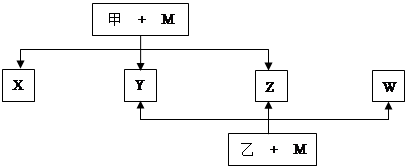
(1)A2D的熔沸点比A2G高的原因是 。B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 。
(2)E4B3和水反应的化学方程式 。
(3)写出M与甲的浓溶液加热时反应的化学方程式 。
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(5)已知CH4 (g)+ 2O2(g)=CO2 (g)+2H2O(l) △H1=a kJ/mol
欲计算反应CH4 (g)+ 4NO (g)=2N2 (g)+CO2 (g)+2H2O(l)的焓变△H2 ,则还需要查找某化合反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时 △H3 =" b" kJ/mol,则该反应的热化学方程式为 。
据此计算出△H2 = kJ/mol(用含a和b的式子表示)。
、
、
、
是元素周期表前四周期中的四种常见元素,其相关信息如下表;
| 元素 |
相关信息 |
|
的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
| 常温常压下,
单质是淡黄色固体,常在火山口附近沉积 |
|
| 和 同周期, 的电负性大于 | |
| 的一种核素的质量数为63,中子数为34 |
(1)
位于元素周期表第周期第)族,
和
最高价氧合物对应的水化物的酸性较强的是(化学式)
(2
是一种常用的溶剂,
的分子中存在个
键。在
,
两种共价键中,键的极性较强的是,键长较长的是。
(3)
的基态原子核外电子排布式是。
在空气中煅烧生成的
化学方程式是。
(4)处理含
验到气污染的一种方法,是将其在催化剂作用下转化为单质
。
已知:
此反应的热化学方程式是
、
、
、
、
五种元素的原子序数依次增大。
、
、
、
是组成蛋白质的基础元素,
是地壳中含量最高的金属元素。
回答下列问题:
⑴
的元素符号为 ;
在元素周期表中的位置为;五种元素的原子半径从大到小的顺序是(用元素符号表示)。
⑵
、
两元素按原子数目比l∶3和2∶4构成分子
和
,
的电子式为,
的结构式为。
⑶ 硒(
)是人体必需的微量元素,与
同一主族,
原子比
原子多两个电子层,则
的原子序数为,其最高价氧化物对应的水化物化学式为。该族2 ~ 5周期元素单质分别与
反应生成l
气态氢化物的反应热如下,表示生成1
硒化氢反应热的是(填字母代号)。
a.+99.7
b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷ 用
单质 作阳极,石墨作阴极,
溶液作电解液进行电解,生成难溶物
,
受热分解生成化合物
。写出阳极生成
的电极反应式;由
生成
的化学方程式:。
作阳极,石墨作阴极,
溶液作电解液进行电解,生成难溶物
,
受热分解生成化合物
。写出阳极生成
的电极反应式;由
生成
的化学方程式:。
有机化合物
的转换关系如下所示:
请回答下列问题:
(1)链烃
有支链且只有一个官能团,其相对分子质量在65~75之间,1
完全燃烧消耗7
氧气,则
的结构简式是,名称是_;
(2)在特定催化剂作用下,
与等物质的量的
反应生成
。由
转化为
的化学方程式是;
(3)
与金属钠反应能放出气体,由
转化为
的化学方程式是;
(4)①的反应类型是;③的反应类型是
(5)链烃
是
的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出
所有可能的结构简式
(6)
也是
的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则
的结构简式为。
在溶液中,反映
分别在三种不同实验条件下进行,它们的起始浓度均为
、
及
。反映物
的浓度随时间的变化如下图所示。

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②;
③;
(2)实验②平衡时
的转化率为;实验③平衡时
的浓度为;
(3)该反应的
>0,判断其理由是;
(4)该反应进行到4.0
时的平均反应速度率:
实验②:
=;
实验③:
=。
有
、
、
、
、
和
六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯
为无色油状液体;
、
、
和
是盐溶液,且他们的阴离子均不同。现进行如下实验:
①
有刺激性气味,用沾有浓盐酸的玻璃棒接近
时产生白色烟雾;
②将
分别加入其它五中溶液中,只有
、
中有沉淀产生;继续加入过量
时,
中沉淀无变化,
中沉淀完全溶解;
③将
分别加入
、
、
、
中,
、
、
中产生沉淀,
中有无色、无味气体逸出;
④将
分别加入
、
、
中,均有沉淀生成,再加入稀
,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法: