用已知浓度的盐酸滴定未知浓度的Na2CO3溶液。用pH传感器测得混合溶液的pH变化曲线如图(已知饱和CO2溶液pH为5.6),下列说法正确的是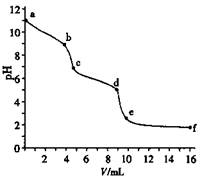
| A.该Na2CO3溶液的浓度为0.001 mol·L—1 |
| B.在pH ="6" 时,c(Na+)>c(HCO3—)>c(CO32—) |
| C.在pH ="7" 时,c(Na+)=c(Cl—) |
| D.c→d发生的主要离子反应:CO32—+H+=HCO3— |
下列叙述正确的是
| A. | 汽油、柴油和植物油都是碳氢化合物 |
| B. | 乙醇可以被氧化为乙酸,二者都能发生酯化反应 |
| C. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| D. | 含5个碳原子的有机物,每个分子中最多可形成4个 单键 |
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是()
| A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多 |
| B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取 |
| C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大 |
| D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是()
| A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-) | B.c(HC2O4-)+ c(C2O42-)=0.1mol/L |
| C.c(C2O42-)>c(H2C2O4) | D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-) |
下列反应不可用于设计原电池的是
| A.NaOH+HCl=NaCl+H2O | B.2CH3OH+3O2→2CO2+4H2O |
| C.Zn+2HCl====ZnCl2+H2 | D.4Al+3O2+6H2O====4Al(OH)3 |
向三份0.1mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 | C.减小、增大、增大 | D.增大、减小、增大 |