已知A、B、C、D、E五种短周期元素,A的最外层电子数是其电子层数的3 倍,A、B同主族,C在短周期主族元素中原子半径最大,E2是黄绿色气体,D为金属元素,其单质可以用于工业冶炼Fe。
(1)D在周期表中的位置是______ ;
A、B、C离子半径由大到小的顺序为______ 。(用离子符号回答)
(2)工业上用E的单质制备漂白粉的化学方程式为
_____ _____ ;
将少量C2A2加入水中可观察到的实验现象是 ;向所得溶液中加入酚酞可观察到溶液先变红后褪色,由此说明溶液中有______ (填化学式)两种物质生成。
(3)D与Fe2O3的反应还可以用于定向爆破,其化学反应方程式为
__ ___ ;
该反应为______(填“吸热”或“放热”)反应。
(4)常温下,将0.0025 mol的BA2E2溶于水配成0.1L溶液,所得溶液的pH= 1,则 BA2E2与水反应的化学方程式为_______ _____。
(1)下图所示是中学化学常用的玻璃仪器,请在下列操作中填入相应的仪器名称
①从氯化钠溶液中获得氯化钠晶体______。
②分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物______。
(2)实验室需用230ml 1.0mol/L的NaOH溶液
①在配制溶液过程中,上述仪器中还缺少的玻璃仪器是:________玻璃捧等。
②计算需称量的NaOH固体质量为_______________g
③配制过程中,下列操作情况会使结果偏低的是
| A.溶解后未冷却直接转移至容量瓶,立即定容 |
| B.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
| C.定容时,俯视容量瓶刻度线观察液面 |
| D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,继续加水定容 |
(3)若 1.0mol/LNaOH溶液的密度为1.1g/cm3,则质量分数为__________%
现有下列物质:
①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸
⑤FeCl3溶液 ⑥铜 ⑦ Fe(OH)3胶体 ⑧蔗糖,
(1)其中属于电解质的是 ,
(2)写出FeCl3的电离方程式:__________________________,
(3)写出NaHCO3(aq) 与稀盐酸反应的离子方程式:_____________________,
(4)胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,
停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做胶体的聚沉。
③区分胶体和溶液常用的方法叫做 。
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。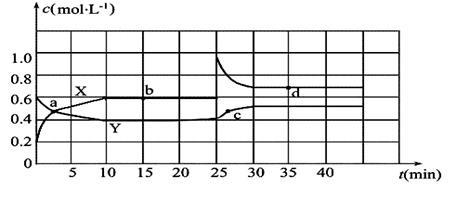
(1)图中共有两条曲线X和Y,其中曲线_______________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是______________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=__________mol·L-1·min-1。
②0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数Kb=_______________。
N2O4(g)的平衡常数Kb=_______________。
③25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数Kd_____________Kb(填“>”、“=”或“<”)。
N2O4(g)的平衡常数Kd_____________Kb(填“>”、“=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_________________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________________。
| A.加入催化剂 | B.缩小容器体积 |
| C.升高温度 | D.加入一定量的N2O4 |
请认真观察下图,然后回答问题: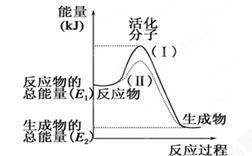
(1)图中所示反应是_______(填“吸热”或“放热”)反应,该反应的ΔH=________(用含E1、E2的代数式表示)。
(2)下列4个反应中,符合示意图描述的反应的是________。
a.盐酸与NaOH反应 b.Na与H2O反应生成H2
c.铝热反应d.灼热的碳与CO2反应
(3)途径(II)与途径(Ⅰ)相比改变的措施可能是 .
铁是当代社会中用量最大的金属之一。磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO 3Fe(s)+4CO2
3Fe(s)+4CO2
(1)已知:①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH="+646.0" kJ/mol
3Fe(s)+4CO(g) ΔH="+646.0" kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH="+172.5" kJ/mol
2CO(g) ΔH="+172.5" kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是 。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是 。
③l0 min内,反应的平均反应速率v (CO2)= 。
④欲提高该反应中CO的平衡转化率,可采取的措施是 (选填字母)。
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K= 。