对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA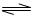 H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。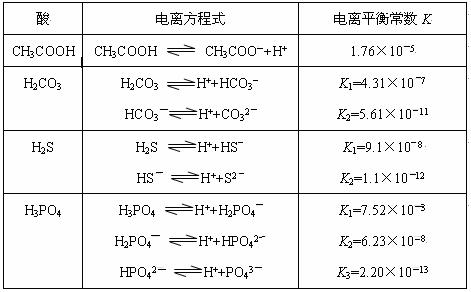
请回答下列各题:
(1)K只与温度有关,当温度升高时,K值______(填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?_______________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_____________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律是K1:K2:K3≈1:10―5:10―10,产生此规律的原因是:________________________。
由环己烷可制得1, 4 – 环己二醇,下列有7步反应(其中无机产物都已略去),试回答以下问题:
(1) 上述反应中属于取代反应有。
(2) 化合物的结构简式:B,C;
(3) 反应④所用试剂和条件是;
(4) 写出反应②、⑤的化学方程式:反应②;
反应⑤。
物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。(提示:葡萄糖结构简式为CH2OH(CHOH)4CHO )
请回答下列问题:
(1)写出下列物质的化学式:B、E、G
(2)利用电解精炼法可提纯C物质,在该电解反应中阳极电极材料是,阴极电极材料是,电解质溶液是
(3)反应②的化学方程式是。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K =(保留一位小数)若温度不变,再加入0.50 mol氧气后重新达到平衡,则:
B的平衡浓度(填“增大”、“不变”或“减小”),
氧气的转化率(填“升高”、“不变”或“降低”),
D的体积分数(填“增大”、“不变”或“减小”)。
(10分)分子中只含有2个碳原子的某烃A是其同系物中含碳量最高的物质; 1mol A与1mol HCl加成可得到B;1mol A与1mol H2加成可得到C,并能继续发生如下列图表所示的转变:
据此回答下列问题
(1) 写出实验室制取A的化学反应方程式
(2)  以B为原料经过加聚反应所得的合成树脂的结构简式为
以B为原料经过加聚反应所得的合成树脂的结构简式为
(3) 写出由D和F生成G的化学反应方程式:
(4) 写出E与银氨溶液反应的化学方程式: __________ ______
______
(5) 写出符合以下两个条件的G的同分异构体,①能水解②能发生银镜反应______________________:
(共19分)
Ⅰ:现有CH4、C2H4、C2H2、C2H6、C3H8五种有机物,回答下列问题:
⑴质量相同时:在相同状况下体积最大的是__ ____,
完全燃烧时消耗O2的量最多的是__ __,
生成CO2最多的是___ _,生成水最多的是___ ___。
⑵同温同压同体积时,五种物质完全燃烧消耗O2的量最多的是__
Ⅱ:有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙苯的制备: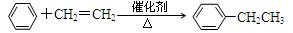
②乙烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色④乙烯使酸性高锰酸钾溶液褪色⑤由乙烯制聚乙烯⑥甲烷与氯气在光照的条件下反应⑦溴乙烷和氢氧化钠的乙醇溶液共热⑧由甲苯制取TNT
(1)其中属于取代反应的是;
属于氧化反应的是;属于加成反应的是;
属消去反应的是属于聚合反应的是
(2)写出⑦和⑧的化学方程式
⑦
⑧
Ⅲ:医药阿斯匹林的结构简式如图1所示: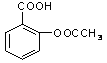
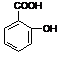
图1图2
试根据阿斯匹林的 结构回答;
结构回答;
⑴阿斯匹林看成酯类物质,口服后,在胃肠酶的作用下,阿斯匹林发生水解反应,生成A和B 两种物质。其中A的结构简式如图2所示,则B的结构简式为;B中含有的官能团名称是。
⑵阿斯匹林跟NaHCO3同时服用,可使上述水解产物A与NaHCO3反应,生成可溶性盐随尿液排出,此可溶性盐的结构简式是
⑶写出阿斯匹林与足量氢氧化钠溶液共热的化学反应方程式
氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水同时得到两种气体(气体A是所有气体中密度最小的气体,气体B是制取漂白粉的原料)和一种易溶、易电离的碱。
(1)试写出电解食盐水的化学方程式(注明反应条件)。
(2)试写出气体B与澄清石灰水反应的离子方程式。