(10分) 按要求完成下列填空
(1)写出下列物质的电离方程式:
Fe2(SO4)3_____________________________________________,
NaHCO3______________________________________________;
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应___________________________________,
氢氧化钡溶液与稀硫酸反应_______________________________;
(3)写出与下列离子方程式相对应的化学方程式:
H+ + OH- ="=" H2O _______________________________________,
CO32- + 2H+ ="=" CO2↑+ H2O_______________________________。
下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
B.有气体参加的化学反应,若增大压强(即缩小反应容 器的体 器的体 积),可增加活化分子的百分数,从而使反应速率增大 积),可增加活化分子的百分数,从而使反应速率增大 |
| C.升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂能降低反应的活化能,但是不能增大单位体积内活化分子的百分数 |
下列说法正确的是
| A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为 c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
可逆反应N2+3H2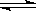 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A 3v正(N2)=v正(H2) B v正(N2)=v逆(NH3)
C 2v正(H2)=3v逆(NH3) D v正(N2)=3v逆(H2)
2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)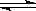 PCl5(g);反应达到平衡时,PCl5为0.4mol;如果此时移走1.0molPCl3 和0.5molCl2,在相同的温度下再达到平衡时,PCl5的物质的量为
PCl5(g);反应达到平衡时,PCl5为0.4mol;如果此时移走1.0molPCl3 和0.5molCl2,在相同的温度下再达到平衡时,PCl5的物质的量为
| A.0.4mol | B.0.2mol | C.小于0.2mol | D.大于0.2mol,小于0.4mol |
在25℃时,分别用pH=9、pH=10的两种氨水中和同浓度、同体积的盐酸,消耗氨水的体积分别为V1和V2,则V1和V2的关系是
| A.V1=10V2 | B.V1>10V2 | C.V1<10V2 | D.V2>10V1 |