有编号为A、B、C、D的四瓶无色液体,仅知道是1%酚酞、0.1mol·L-1NaOH溶液、0.1mol·L-1盐酸和0.1mol·L-1NaCl溶液。化学老师现要求甲、乙、丙、丁四位学生对它们进行鉴别,规定每人只需鉴别两瓶溶液,如果两瓶溶液鉴别都正确,得满分,如果只有一瓶鉴别正确,则算及格。以下是四位学生的鉴别结果:
| A |
A为0.1mol·L -1盐酸 |
D为0.lmol·L-1NaCl溶液 |
老师评价:四位学生都及格,但是没有一个得满分 |
| B |
A为0.1mol·L -1NaOH溶液 |
C为0.1mol·L-1盐酸 |
|
| C |
A为1%酚酞 |
B为0.1mol·L-1盐酸 |
|
| D |
D为0.1mol·L-1盐酸 |
B为0.1mol·L-1 NaOH溶液 |
下列结论正确的是
A.A为1%酚酞 B.B为0.1mol·L-1NaCl溶液
C.C为0.1mol·L-1NaOH溶液 D.D为0.1mol·L-1盐酸
【原创】下列叙述正确的是
| A.向100mL0.1mol/L 的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2="2" Fe3++2Br2+6Cl- |
| B.能溶解Al(OH)3的溶液中,Fe3+、Na+、Cl‾、ClO‾一定能大量共存 |
| C.常温下,将pH=2的H2SO4溶液与pH=12的氨水等体积混合,反应后溶液呈酸性 |
| D.pH相等的CH3COONa、Na2CO3、Na2SO3、KOH溶液,溶质物质的量浓度由大到小的顺序为:KOH> Na2CO3>CH3COONa> Na2SO3 |
如图是一种可充电的锂离子电池充、放电的工作示意图。该电池的反应式为:
LiMnO2 + C6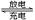 Li1-x MnO2 +LixC6(LixC6表示锂原子嵌入石墨形成的复合材料)下列有关说法正确的是
Li1-x MnO2 +LixC6(LixC6表示锂原子嵌入石墨形成的复合材料)下列有关说法正确的是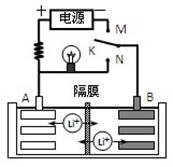
| A.K与N相接时,A极为负极,该电极反应式为:LixC6 - xeˉ= C6 + xLi+ |
| B.在整个充电或放电过程中都只存在一种形式的能量转化 |
| C.K与N相接时,Li+由A极区迁移到B极区 |
| D.K与M相接时,A极发生氧化反应,LiMnO2 -xeˉ = Li1-xMnO2 + xLi+ |
用下图装置制取、收集纯净气体的是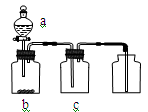
| 气体 |
a |
b |
c |
|
| A |
NO |
稀硝酸 |
铜片 |
浓硫酸 |
| B |
O2 |
H2O2 |
MnO2 |
浓硫酸 |
| C |
NH3 |
浓氨水 |
生石灰 |
碱石灰 |
| D |
Cl2 |
浓盐酸 |
MnO2 |
浓硫酸 |
【原创】某有机物常用于制备液晶材料,结构简式为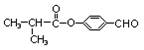 ,则下列说法正确的是
,则下列说法正确的是
| A.该有机物的分子式为C12H8O3 |
| B.该有机物可以发生水解反应、加成反应、氧化反应、还原反应 |
| C.该有机物的一溴代物有4种 |
| D.该物质属于芳香烃 |
X、Y为短周期元素,X位于第IA族,X与Y可形成化合物X2Y,下列说法不正确的是
| A.两元素还可能形成原子个数比为1:1的化合物 |
| B.X与Y的简单离子可能具有相同电子层结构 |
| C.X的原子半径一定大于Y的原子半径 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |