铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3和SiO2及其它不溶于NaOH溶液的杂质。从铝土矿中提炼Al2O3的流程如下:
回答下列问题:
(1)写出反应1的化学方程式 ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
(8分)有一包白色粉末,其中可能含有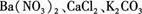 ,现做以下实验。
,现做以下实验。
(1)将部分粉末加入水中,振荡,有白色沉淀生成;
(2)向(1)的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
(3)取少量(2)的溶液滴入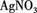 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
根据上述实验 现象,判断白色粉末中一定含有(填化学式),可能含自(填化学式)。写出(3)中有关反应的离子方程式。
现象,判断白色粉末中一定含有(填化学式),可能含自(填化学式)。写出(3)中有关反应的离子方程式。
(8分)2molCO2的质量为g,含分子数约为个,在标准状况下所占有的体积约为L,含氧原子的物质的量为mol。
(4分)小苏打是厨房里的常见物质,是发酵粉的主要成分,请 写出小苏打的化学
写出小苏打的化学
式,若食盐中可能混入了少量小苏打,用下列厨房中的进行检验。
A .白酒 B.食醋 C.酱油 D.白糖
.白酒 B.食醋 C.酱油 D.白糖
从环己烷可制备1,4环己二醇的二醋酸酯,下面是有关的化学反应过程(其中的无机物均已略去)。回答下列有关问题。
(1)反应②的类型是______________,反应⑧的类型是_____________。
(2)反应④的条件、试剂是
(3)写出B、C的结构简式:B________________; C_____________________
(4)写出反应②⑤的化学方程式_________________________________ _________________________________________________________。
在一定条件下,某些不饱和烃分子之间可以发生自身加成反应,如: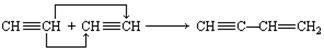
有机物甲的结构简式为: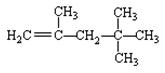 它是由不饱和烃乙的两
它是由不饱和烃乙的两
个分子在一定条件下自身加成而成得到的。在此反应中除生成甲外,还得到另一种产量更多的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体。则乙和丙的结构简式分别为:
___________________________, ___________________________。