铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃-60℃的两个原因除了加快反应速率外,还有 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式 。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO, 其猜想可用化学方程式表示为:
Cu + H2SO4
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是 (填字母)
a.Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式 。若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,Na3BiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的Na3BiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为___________________________;
(2)实验④中的现象为:________________________________________________;
(3)实验②反应的离子方程式是:
__________________________________________________________________;
(4)实验③反应的离子方程式是:________________________________________。
有机物A相对分子质量为100,1mol A充分燃烧后只生成4mol CO2和2mol H2O,该有机物有如下转化关系:
试回答:
(1)1mol A与2mol H2反应生成1mol E,其反应方程式是______________________。
(2)与A具有相同官能团的A的同分异构体的结构简式是______________________。
(3)B酸化后与Br2反应得到D,其反应类型是______________________。
(4)F的结构简式是_____________________。
可逆反应的特点是同一反应,能同时向相反的两个方向,充分反应后最终各种物质共存在一起。现将0.2molSO3放在某密闭容器中加热使其分解:2SO3 2SO2+O2。
2SO2+O2。
(1)容器中SO2与O2分子数目比为___________,质量比为__________
(2)最终容器内硫原子与氧原子个数比为__________
(3)反应中,气体分子数目_________(填增加、减少、不变),将充分反应后的混合气体通入适量的BaCl2溶液中,生成的沉淀是_____________;若是通入到足量的NaOH 溶液中,则生成的盐化学式为________________________
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。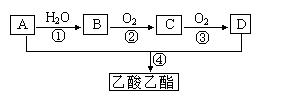
回答下列问题:
(1)写出A的电子式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的反应类型: ①,④。
(4)写出下列反应的化学方程式:
①;
②;
A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应。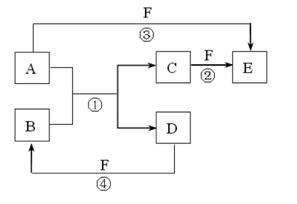
请回答下列问题:
(1)若B是黄绿色气体,C、F是空气的主要成分,A、D相遇有白烟生成,则该白烟的化学式为,反应③的化学方程式为。
(2)若A、D、F都是非金属单质,A、D所含元素同主族,A、F所含元素同周期,则B所属晶体类型是,其一个重要的用途是。
(3)若A是常见的金属单质,D、F是气态单质,反应①②在水溶液中进行,则反应②的离子方程式为。工业上冶炼金属A的反应原理是(用化学方程式表示)。
(4)若A、D是常见单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,反应③④中都有红棕色气体生成。则反应①的化学方程式为
。