Ⅰ.卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性
质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 |
现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 |
随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 |
溶液的蓝色逐渐褪去 |
请回答:
(1)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(2)若用y表示锥形瓶中含碘物质的物质的量 ,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
Ⅱ.过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序:
甲同学:⑤—⑧—③—⑦—④; 乙同学:⑤—③—②。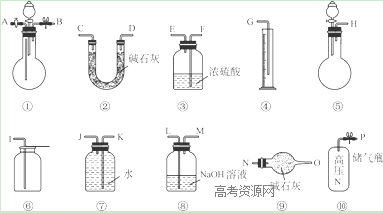
已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O。
(1)甲同学想通过实验测得的数据是____________,他选用的装置________(填序号)是没有必要的。
(2)乙同学想通过实验测得的数据是________________。有人认为按他测得的数据计算出的实验结果可能偏高,原因是________________; 为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用):________________(填序号)。
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)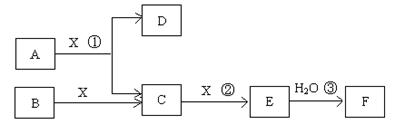
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式:。
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是。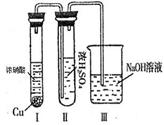
③已知常温下1 mol气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方式。
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为;
②将少量气体E通入氢氧化钡溶液中得不溶物G,G的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP,(填:增大、减小或不变),此时,组成不溶物G的阴离子在溶液中的浓度为mol/L。
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)ΔH="-566" kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
CO (g)+H2O(g) CO2(g)+H2 (g)
CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
| 时间 / min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。则第4~5min之间,改变的条件,第5~6min之间,改变的条件是。
已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为。又知397℃时该反应的平衡常数为12,请判断该反应的△H0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;
燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—移向____极(填“正”或“负”);电池的负极反应式为。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____。
【化学-物质结构与性质】
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用。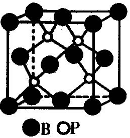
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为,B原子的杂化类型为。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图示意的是磷化硼的晶体结构单元,则磷化硼的化学式为,微粒间存在的作用力为。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连(如下图)。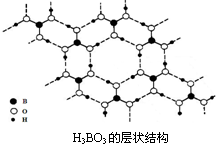
①硼酸分子中B最外层有个电子,1 mol H3BO3的晶体中有mol氢键。
②硼酸溶于水应生成弱电解质一水合硼酸H2OB(OH)3,它电离生成少量[B(OH)4]-和的H+离子。则硼酸为元酸, [B(OH)4]-含有的化学键类型为。
【化学-化学与技术】
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下:
2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下: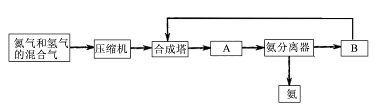
(1)合成氨所需要的原料气中,氮气取自,氢气来源于。
(2)对原料气进行净化处理的目的是。
(3)设备A的名称是,设备B的名称是。
(4)在10~30Mpa时,工业合成氨选择400~500 ℃的温度进行反应,主要原因是。
(5)据《科学》杂志报道,希腊化学家在常压下将氢气和用氢气稀释的氮气分另通入一个加热到570 ℃的电解池(如图)中,氢和氮在电极上合成了氨,且转化率达到了78%。
则阳极反应为,阴极反应为。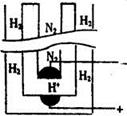
煤炭气化可以提高燃料的利用率,又可以合成新型能源。
(1)煤炭气化时发生的反应为:C(s)+H2O(g) H2(g)+CO(g)。
H2(g)+CO(g)。
①已知:2C (s)+O2(g)=2CO (g);△H1=–221.0 kJ mol–1
2H2(g)+O2(g)=2H2O (g);△H2=–483.6 kJ mol–1
则煤气化反应的△H=。
②煤气化反应的平衡常数表达式K=,温度升高,平衡常数。
(2)水煤气可以合成甲醇:CO(g)+2H2(g) CH3OH(g)。一定条件下,向体积为1 L的密闭容器中充入1 mol CO和3 mol H2,反应达到平衡状态时,CO的平衡转化率为75%。
CH3OH(g)。一定条件下,向体积为1 L的密闭容器中充入1 mol CO和3 mol H2,反应达到平衡状态时,CO的平衡转化率为75%。
①从反应开始到平衡,H2的平均反应速率υ(H2)=。
②反应达平衡后充入适量氢气并维持H2浓度和容器的温度不变,增大容器的体积,跟原平衡相比较达到新平衡时CO的转化率(填“增大”、“不变”或“减小”),其原因是。
③将3.2 g甲醇充分燃烧后的产物通入75 mL2 mol/L的NaOH溶液,所得溶液中离子浓度大小顺序为。