在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: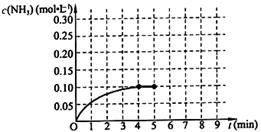
根据图,计算从反应开始到平衡时,平均反应速率v(NH3)= 。
⑵下列描述中能说明上述反应已达平衡的是 。
| A.3v正(H2)=2v逆(NH3) |
| B.容器中气体的平均相对分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中气体的分子总数不随时间而变化 |
⑶ 第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
4g D2和20g18O2化合时最多能生成g D218O,1mol D218O中含mol质子,含mol中子。
有下列物质:①CaCl2 ②PH3 ③H2O2 ④Na2O2 ⑤KOH ⑥(NH4)2SO4 ⑦F2(答题填编号)
(1)含有离子键的物质,含有非极性键的离子化合物;
(2)含有极性键的物质;
(3)含有非极性键的共价化合物;
丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为 C4H8,A氢化后得到2-甲基丙烷。完成下列填空:
(1)A可以聚合,写出A发生加聚反应的方程式________________________________。
(2)A与某烷发生反应生成分子式为C8H18的物质B,B的一卤代物只有4种,且碳链不对称。写出B的结构简式___________________________。
(3)将A通入溴的四氯化碳溶液中发生的反应类型为__________________,
写出该反应的方程式_______________________________。
(4)A的单烯烃同分异构体中,有一种具有顺反异构,分别写出该顺反异构的结构简式
_____________________________、______________________________
(共14分)锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
(1)a电极为__________极(填“正”或“负”)。
(2)电池正极反应式为_______________________。
(3)是否可用水代替电池中的混合有机溶_______(填“是”或“否”),原因是_________________。
(4)MnO2与双氧水混合化学方程式为;MnO2的作用是。
(5)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为________________,K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
完成下列小题(共12分)
(1)主链含5个碳原子,有2个甲基作支链的烷烃有_______种。其中有一种同分异构体的分子,其一氯代物有4种同分异构体,写出其结构简式___________________,并对其命名____________。其中另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称______________.
(2)已知某有机物A在标况下的密度为1.34g/L,取A与氧气反应,得到等物质的量的CO2和H2O,则该有机物的分子式为______________。为测定A的结构,作核磁共振氢谱,发现只有一种吸收峰,则A可能的结构简式为____________。