Ⅰ、甲同学欲配制0.55 mo1·L—1 的NaOH溶液200mL(存在200mL容量瓶)。称量操作如下:
①先用托盘天平称量烧杯的质量。称量前先调节天平零点。用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码。取用砝码情况和游码读数如下:
| 砝码质量 |
50 |
20 |
20 |
10 |
5 |
| 取用砝码情况 |
先↓后↑ |
↓ |
先↓后↑ |
↓ |
先↓后↑ |

烧杯的质量为 g。
②称量烧杯和NaOH固体的质量。再在天平右盘上放置 g砝码,将游码的位置移到 g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡。
Ⅱ、乙同学欲用用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④ 转移
⑤洗涤 ⑥定容 ⑦摇匀
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (请填编号)(从下列中选用 A.10ml B.25ml C.50ml D.100ml)
(2)定容时俯视溶液的凹液面对所配制的稀硫酸浓度有何影响
(用偏大、偏小、无影响填写)
NH3、H2S等是极性分子,CO2、BF3、CCl4等是含极性键的非极性分子。根据上述实例可推出ABn型分子是非极性分子的经验规律是( )
| A.分子中不能含有氢原子 |
| B.在ABn分子中A的相对原子质量应小于B的相对原子质量 |
| C.在ABn分子中A原子没有孤电子对 |
| D.分子中每个共价键的键长应相等 |
下列事实与氢键有关的是( )
| A.水加热到很高的温度都难以分解 |
| B.水结成冰体积膨胀,密度变小 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D.HF、HCl、HBr、HI的热稳定性依次减弱 |
用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示据此分析,A、B两种液体
分子的极性正确的是( )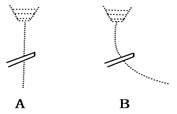
A.A是极性分子,B是非极性分子
B.A是非极性分子,B是极性分子
C.A、B都是极性分子
D.A、B都是非极性分子
下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是( )
| A.CO2和SO2 | B.CH4和SiO2 | C.BF3和NH3 | D.HCl和HI |
金刚石是典型的原子晶体,下列关于金刚石的说法中错误的是( )
| A.晶体中不存在独立的“分子” |
| B.碳原子间以共价键相结合 |
| C.是硬度最大的物质之一 |
| D.化学性质稳定,即使在高温下也不会与氧气发生反应 |