现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
所选用装置的连接顺序为(填各接口的字母): 。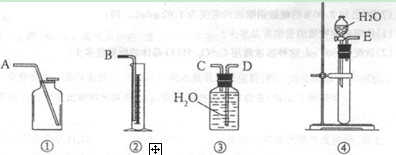
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.50g,并称量锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表。
| |
读数次数 |
质量/g |
| 锥形瓶+水+试样 |
第1次 |
196.30 |
| 第2次 |
196.15 |
|
| 第3次 |
196.05 |
|
| 第4次 |
196.00 |
|
| 第5次 |
196.00 |
①计算CaC2的质量分数时,不必作第6次读数的原因是: 。
②此试样中CaC2的质量分数为 。(保留2位有效数字)
(3)第三种方案:称取一定质量的试样(1.60g),操作流程如下: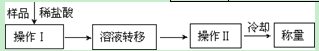
①操作Ⅱ的名称是 。
②在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果 (填“偏大”、“偏小”或“不变”)。
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如图转化关系(部分反应物、产物及反应条件已略去)。请回答:
(1)W的电子式是 。
(2)X与Y在溶液中反应的离子方程式是
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
①装置Ⅱ中物质的化学式是 。
装置I中反应的化学方程式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,该化合物的化学式是 ,所需仪器装置是
(从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成。该反应的化学方程式是 。
某研究小组进行与NH3有关的系列实验
(1)从下图中挑选所需的仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。
(2)将NH3通入溴水中,有N2生成,反应的化学方程式为
(3)为验证“同温同压下,相同体积的任何气体都含有相同数目的分子”,该小组同学设计了如图所示的装置,图中B管的容积是A管的2倍,活塞K1、K2、K3、K4、K5均关闭(固定装置和尾气处理装置略;HCl和NH3均不溶于石蜡油,也不与之反应;)
①简述检验该装置气密性的方法
。
②在A管中充满与大气压强相等的干燥HCl气体,操作是
。
控制活塞K4、K5,调节C,使B管充满与A管同压的干燥NH3。
③缓慢开启活塞K3,A管中的现象是 。要达到实验目的,当反应完成并恢复到室温时,B管中预期的现象是 ;
若观察不到预期现象,主要原因是
。
某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向溶液中滴加稀硫酸至溶液pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、 、 等玻璃仪器。
(2)步骤1过滤的目的是 。
(3)当步骤2中溶液的pH=8~9时,检验沉淀是否完全的方法是
。
(4)简述你认为调节pH=8~9时的简单方法:
。
(5)步骤2中溶液的pH较难控制,可改用 。
Ⅰ.下图是实验室制备乙酸乙酯的装置图,填写下列空白。
(1)试管A中加入沸石的作用是:__________。导管B的作用是导气和___________。
(2)试管C中的饱和碳酸钠溶液作用是:溶解乙醇、中和乙酸、____________。装置中通蒸汽的导管要插在溶液的液面以上,不能插在溶液中,目的是:________________。
(3)要将乙酸乙酯从试管C的混合物中分离出来,必须用到的仪器是_________。
Ⅱ.下图是实验室石油分馏的装置图,填写下列空白。
(4)A仪器的名称是____________,B仪器的名称是____________,B仪器内的水流方向是_______________(选答“上进下出”或“下进上出”)。
下列有关化学实验的操作或说法中,正确的是(填字母代号)。
| A.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合 物变稠,即可得到肥皂 |
| B.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度 |
| C.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴~3滴即可 |
| D.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸发滤液即可得硫酸亚铁晶体 |
E.进行纤维素水解实验时,把一小团蓬松脱脂棉放入试管,滴入少量浓硫酸搅拌,使脱脂棉变成糊状,再加入一定量的水,加热至溶液呈亮棕色,然后加入新制的Cu(OH)2加热至沸腾即可
F、实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
G.用50mL量筒量取3.80mL盐酸 H.在氢氧化铁胶体中滴加少量稀硫酸会产生沉淀