下列解释实验现象的反应方程式正确的是
| A.将切开的金属Na暴露在空气中,表面由光亮逐渐变暗 2Na + O2 =Na2O2 |
B.电解氯化镁溶液产生黄绿色气体 2C1− + 2H2O Cl2↑+ H2↑+ 2OH− Cl2↑+ H2↑+ 2OH− |
| C.向AgC1悬浊液中滴加KI溶液,白色沉淀变成黄色 AgC1 + I−= AgI↓+ C1- |
D.向Ca(HCO3)2溶液中加入过量的烧碱溶液,出现白色沉淀HCO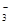 + Ca2+ + OH−= CaCO3↓ + H2O + Ca2+ + OH−= CaCO3↓ + H2O |
常温下,Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6。含有MgCO3沉淀的MgCl2溶液中,已知c(Mg2+)="0.2" mol/L。如果加入等体积的CaCl2溶液,若要产生CaCO3沉淀,加入CaCl2溶液的物质的量浓度最小约为
| A.7.27×10-5mol/L | B.1.45×10-4mol/L |
| C.2.9×10-4mol/L | D.5.8×10-4mol/L |
体积为1 L的某溶液中含有的离子如表所示:
| 离子 |
Cu2+ |
Al3+ |
 |
Cl- |
 |
1 |
1 |
a |
1 |
用Pt电极电解该溶液,当电路中有3 mol电子通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是
A.阴极析出的金属是铜与铝B.a=3
C.阳极生成1.5 mol Cl2D.电解后溶液的pH=0
在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图,下列判断一定错误的是
2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图,下列判断一定错误的是
| A.图I研究的是压强对反应的影响,且乙的压强较高 |
| B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
下列对于25 ℃时pH为12的氨水,叙述正确的是
A.加入一定量pH=2的醋酸,混合后所得的溶液中:c(CH3COO-)+c(OH-)=c( )+c(H+) )+c(H+) |
| B.向其中加入一定量的水,NH3·H2O的电离平衡正移,溶液中所有离子浓度均减小 |
C.与等体积、pH=2的盐酸混合后所得的溶液中:c(Cl-) >c( )> c(H+)>c(OH-) )> c(H+)>c(OH-) |
D.c( )+c(NH3·H2O)=1.0×10-12 mol·L-1 )+c(NH3·H2O)=1.0×10-12 mol·L-1 |
下列说法不正确的是
| A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 |
| B.常温下,向Mg(OH)2饱和溶液中加入NaOH溶液,Mg(OH)2的Ksp不变 |
| C.带有“盐桥”的铜锌原电池比不带“盐桥”的铜锌原电池电流持续时间长 |
| D.对滴加酚酞的NaHCO3溶液加热,红色加深,是因为加热时NaHCO3分解生成Na2CO3,碱性增强 |