常温下,Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6。含有MgCO3沉淀的MgCl2溶液中,已知c(Mg2+)="0.2" mol/L。如果加入等体积的CaCl2溶液,若要产生CaCO3沉淀,加入CaCl2溶液的物质的量浓度最小约为
| A.7.27×10-5mol/L | B.1.45×10-4mol/L |
| C.2.9×10-4mol/L | D.5.8×10-4mol/L |
在298 K、1.01×105 Pa下,将32 g SO2通入750 mL 1 mol/L KOH溶液中充分反应。测得反应放出x kJ的热量。已知在该条件下,1 mol SO2通入1 L 2 mol/L KOH溶液中充分反应放出y kJ的热量。则SO2与KOH溶液反应生成KHSO3的热化学方程式正确的是()
| A.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(4x-y)" kJ/mol |
| B.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(2x-y)" kJ/mol |
| C.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(2y-x)" kJ/mol |
| D.2SO2(g)+2KOH(l)=2KHSO3(l)ΔH="-(8x-2y)" kJ/mol |
反应A(g)+B(g)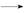 C(g) ΔH,分两步进行:①A(g)+B(g)
C(g) ΔH,分两步进行:①A(g)+B(g)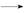 X(g) ΔH1
X(g) ΔH1
②X(g)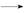 C(g) ΔH2,反应过程中能量变化如图所示,E1表示A(g)+B(g)
C(g) ΔH2,反应过程中能量变化如图所示,E1表示A(g)+B(g)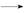 X(g)的活化能,下列说法正确的是()
X(g)的活化能,下列说法正确的是()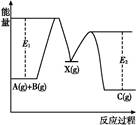
| A.ΔH1=ΔH-ΔH2>0 |
B.X(g)是反应A(g)+B(g)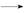 C(g)的催化剂 C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
下列说法中错误的是()
| A.电解饱和食盐水,生成物总能量比反应物总能量高 |
| B.化学反应过程中,发生物质变化的同时一定发生能量变化 |
| C.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高 |
| D.食盐可用于融化冰雪,且用食盐作融雪剂不会对环境、植物生长产生任何危害 |
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2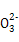 +O2+aOH-
+O2+aOH- Y+S4
Y+S4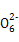 +2H2O,下列说法中,不正确的是()
+2H2O,下列说法中,不正确的是()
| A.a=4 |
| B.Y的化学式为Fe2O3 |
C.S2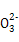 是还原剂 是还原剂 |
| D.每有1 mol O2参加反应,转移的电子为4 mol |
下列离子方程式书写正确的是()
A.铜溶于浓硝酸:Cu+4HNO3(浓) Cu2++2NO2↑+2H2O Cu2++2NO2↑+2H2O |
B.硫酸铁溶液与氢氧化钡溶液混合:Fe3++S +Ba2++3OH- +Ba2++3OH- Fe(OH)3↓+BaSO4↓ Fe(OH)3↓+BaSO4↓ |
C.次氯酸钙溶液中通入过量的CO2:ClO-+H2O+CO2 HC HC +HClO +HClO |
D.碳酸氢镁与足量的石灰水反应:Mg2++2HC +2OH-+Ca2+ +2OH-+Ca2+ CaCO3↓+MgCO3↓+2H2O CaCO3↓+MgCO3↓+2H2O |