氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,仅铁架台和夹持仪器已略去。
部分物质的有关物理数据如下:
| 化学式 |
熔点(单位:℃) |
沸点(单位:℃) |
| N2 |
-209.86 |
-195.8 |
| O2 |
-218.4 |
-183 |
| CO2 |
-57 |
/ |
| NH3 |
-77.3 |
-33.35 |
| Cl2 |
-101 |
-34.6 |
试回答:
(1)A中深色固体与无色液体制备气体的离子方程式: 。
(2)B中盛有液体c是饱和 ,C中的液体d是浓硫酸。
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是
(在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的 。
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无 管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而 。
DIS(Digital Information System)系统即数字化信息系统,它由传感器、数据采集器和计算机组成。DIS系统为化学教学提供了全新的技术手段和教学平台。某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
(1)用______________(填仪器名称)量取10.00mL食用白醋,在_________(填仪器名称)中用水稀释后转移到100mL_______(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
(2)量取20.00mL上述溶液倒入烧杯中,连接好 DIS系统(如右图),向烧杯中滴加浓度为0.1000mol·L-1的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见右下图)。
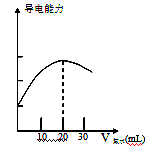
①用滴定管盛氨水前,滴定管要用____________润洗2~3遍,
润洗的目的是____________________________________。
②溶液导电能力随氨水体积变化的原因是__________________________________________。
③食用白醋中醋酸的物质的量浓度是_____________。
环境保护是我国的一项基本国策。含CN-的污水毒性和危害极大。治理含CN-污水的方法之一是:在催化剂TiO2作用下,用NaClO将CN-氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化成CO2、N2和H2O。其离子反应方程式为:2CN-+5ClO-+2H+===2CO2↑+N2↑+5Cl-+H2O,试根据要求回答下列问题: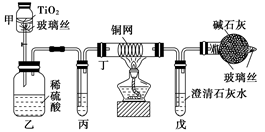
(1)将浓缩后含CN-的污水(其中CN-浓度为0.05 mol/L)200 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。
①乙装置中生成的气体除含有CO2、N2、HCl外还有副反应生成的Cl2等,写出生成Cl2的副反应的离子方程式: _______________________________________。
②丙中加入的除杂试剂是________(填字母代号)。
| A.饱和食盐水 | B.饱和碳酸氢钠溶液 |
| C.浓NaOH溶液 | D.浓硫酸 |
③丁在实验中的作用是_______________________________________________________。
④戊中盛有足量石灰水,若实验后戊中共生成0.8 g沉淀,则该实验中CN-被处理的百分率________(填“>”、“=”或“<”)80%。(不考虑CO2的溶解)
(2)上述实验中造成戊中碳酸钙质量测定值偏小的可能原因有(写出两点即可):________________________________________________________________________。
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到沉淀。
甲同学认为两者反应只有CuCO3一种沉淀生成;
乙同学认为这两者相互促进水解反应,生成Cu(OH) 2一种沉淀;
丙同学认为生成CuCO3和Cu(OH) 2两种沉淀。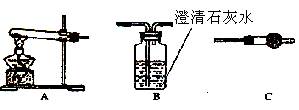
(1)各装置连接顺序为 →→ 。
(2)若甲同学的结论正确,实验现象为 。
II.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。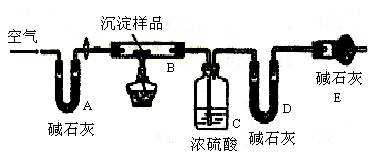
(1)仪器组装好后首先要进行的实验操作是 ,实验结束时要继续通入处理过的过量空气,其作用是。
(2)若沉淀样品的质量为mg,当反应完全后,装置C质量增加了ng,则沉淀中CuCO3的质量分数为。
III.沉淀转化在生产中也有重要应用。例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松瓶易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=___________(写数值)。[已知Ksp(CaSO4)=9.1×10—6,Ksp(CaCO3)=2.8×10—9]
IV.蓝铜矿的主要成分为2CuCO3·Cu(OH)2,当它与焦炭一起加热时,可以生成铜、二氧化碳和水,写出该反应的化学方程式_____________________________________________
下图为实验室制取和收集纯净干燥的氯气,并进行氯气的性质实验的装置图: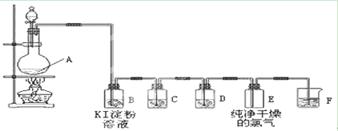
(1)反应前,在装置A中装浓盐酸(填写仪器名称)
装MnO2(填写仪器名称)
装置A中反应的化学方程式为 。
(2)装置B中的现象是
反应的化学方程式为 。
(3)装置D中所装试剂是,作用是。
(4)装置F中发生反应的离子方程式为
实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液
| 应称取NaOH的质量/g |
应选用容量瓶的规格/mL |
除天平(砝码)、量筒、容量瓶、玻璃棒、胶头滴管外还需要的其它仪器 |
(2)容量瓶上需标有以下五项中的;A
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)下列配制的溶液浓度偏低的是;
A、称量NaOH时,砝码错放在左盘
B、向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
C、加蒸馏水时不慎超过了刻度线
D、定容时俯视刻度线
E、配制前,容量瓶中有少量蒸馏水