(1)含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知: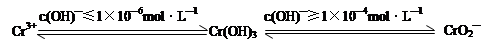
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式 。
②完成用离子方程式表示溶液pH不能超过10(即c(OH)—≥1×10—4mol·L—1)的原因为Cr(OH)3 + OH-= +2H2O。
(2)在硝酸工业生产吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5% NO、1.5% NO2)用纯碱溶液完全吸收,完成反应方程式:NO+3NO2+2Na2CO3=3NaNO2+NaNO3+2 ,该反应中能用纯碱代替氢氧化钠溶液发生反应的原因是利用了Na2CO3水解呈现的 性。
(3)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量ƒ随pH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,完成有关反应的离子方程式为:
___________+3OH-=Al(OH)3↓+2F-;__________+3OH-=Al(OH)3↓+3F-。
Ⅰ.下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。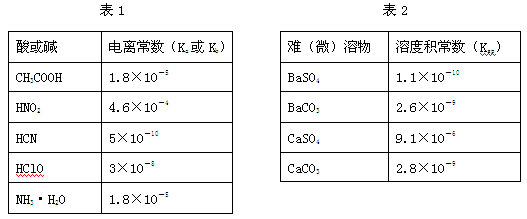
请回答下面问题:
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是(填序号)。
| A.升高温度 | B.加水稀释 |
| C.加少量的CH3COONa固体 | D.加少量冰醋酸 |
(2)CH3COONH4的水溶液呈(选填“酸性”、“中性”、“碱性”)。
(3)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g) 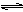 CH3CH2OH(g)+3H2O(g)△H=a kJ/mol
CH3CH2OH(g)+3H2O(g)△H=a kJ/mol
在一定压强下,测得上述反应的实验数据如下表。
根据表中数据分析:
①上述反应的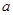 0(填“大于”或“小于”)。
0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即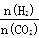 )比,平衡常数K值(填“增大”、“减小”、或“不变”)。
)比,平衡常数K值(填“增大”、“减小”、或“不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示: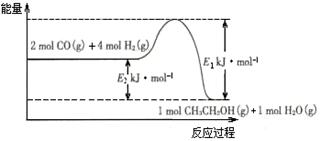
①写出CO和H2制备乙醇的热化学反应方程式。
②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为。
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是。
汽车尾气是造成天气雾霾的重要原因。已知:
①N2(g)+O2(g) 2NO(g) ΔH1②2NO(g)+O2(g)
2NO(g) ΔH1②2NO(g)+O2(g) 2NO2(g)ΔH2
2NO2(g)ΔH2
③CO2(g) CO(g)+1/2O2(g)ΔH3④2CO(g)+2NO(g)
CO(g)+1/2O2(g)ΔH3④2CO(g)+2NO(g) N2(g)+2CO2(g)ΔH4
N2(g)+2CO2(g)ΔH4
请完成以下问题:
(1)请根据反应①②③,确定反应④中ΔH4=。
(2)根据图1,反应④的热化学方程式为:。
该反应在(填“高温”“低温”或“任意温度”)下有利于该反应正向自发。
(3)图2表示反应④的反应物NO、CO的起始物质的量比、温度对平衡时CO2的体积分数的影响。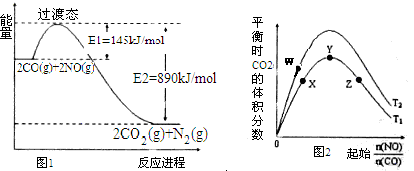
①W、Y、Z三点的平衡常数的大小关系为:, X、Y、Z三点,CO的转化率由大到小的顺序是。
②T1℃时,在1L密闭容器中,0.1molCO和0.1molNO,达到Y点时,测得NO的浓度为0.02mol/L,则此温度下平衡常数K=。若此温度下,某时刻测得CO、NO、N2、CO2的浓度分别为0.01 mol/L、a mol/L、0.01 mol/L、0.04 mol/L,要使反应向正方向进行,a的取值范围为。
(4)恒温恒容时,反应④中NO、CO按一定比例投料,反应过程中CO浓度随时间的变化关系如图3所示,请在同一图中绘出N2浓度随时间的变化曲线。
【化学——选修5:有机化学基础】
A、B均为重要的有机化工原料,可用于合成聚碳酸酯等工程塑料并存在如下转化关系: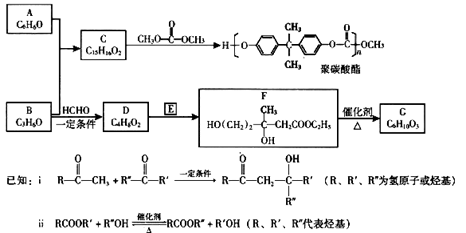
回答下列问题:
(1)A分子内含有苯环,则A的名称是。
(2)A与B反应生成C时的理论用量(物质的量)比是。
(3)B分子结构中只有一种化学环境相同的氢原子,B的一种同分异构体能发生银镜反应,该反应的化学方程式是。
(4)D和E反应生成F是加成反应,D的结构简式是,E的分子式是,F生成G的反应类型是反应?
(5)G分子内含有六元环,可发生水解反应,其结构简式是。
【化学——选修3:物质结构与性质】
前四周期原子序数依次增大的元素A、B、C、D中,A、B、C均处于第二周期且价电子层中未成对电子数分别为2、3、2:D为ds区元素且最外电子层上只排布了一个电子。
回答下列问题:
(1)D2+的价层电子排布图为。
(2)A、B、C三种元素中第一电离能由小到大的顺序是,电负性最大的是(填元素符号):
(3)AC32—的立体构型是,其中A原子的轨道杂化类型为;[D(AB) 4]3—离子中配位数是。
(4)Y(钇)、Ba(钡)、D、C四种元素组成的一种化合物是高温超导体,其品胞如图所示。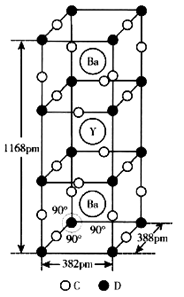
①该化合物的化学式为;已知钇、钡的化合价分别为+3、+2,则D2+与D3+的离子数之比为;
②列式计算该晶体的密度g·cm-3。
【化学——选修2:化学与技术】
锂电池在人们生产生活中的应用十分广泛,其消耗量巨大,对不可再生的金属资源造成了相当大的消耗。因此,锂离子的电池回收具有重要的意义。其中需要重点回收的是正极材料,其主要成分为钴酸锂( LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂:
某工厂的回收工艺流程如下: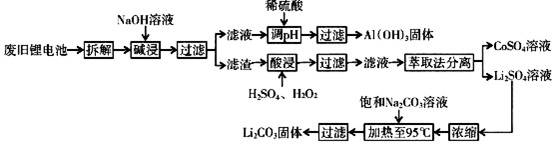
(1)上述工艺回收到的产物有。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是。
(3)滤液用稀硫酸调pH时反应的离子方程式为。
(4)酸浸时反应的化学方程式为。如果用盐酸代替H2SO4和H2O2混合液中的H2SO4也能达到溶解的目的,但不利之处是。
(5)生成Li2CO3的化学反应方程式为。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应该。