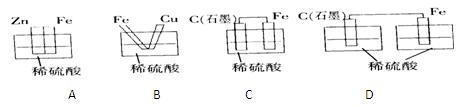
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是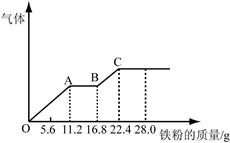
| A.混合酸中HNO3物质的量浓度为2 mol·L-1 |
| B.原混合酸中H2SO4物质的量为0.4 mol |
| C.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| D.第二份溶液中最终溶质为FeSO4 |
一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z(g),达到反应限度的标志是
Y(g)+Z(g),达到反应限度的标志是
①X的分解速率与X的生成速率相等②反应容器中压强不再变化
③X、Y、Z的浓度不再变化④单位时间内生成lmolY的同时生成lmolZ
| A.①③ | B.②③ | C.①② | D.②④ |
反应3X(g)+Y(g) 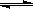 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率v为
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率v为
| A.V(X)=0.05mol·L—1·min—1 | B.V(Y)= 0.10mol·L—1·min—1 |
| C.V(Z)=0.10mol·L—1·min—1 | D.V(W)=0.05mol·L—1·s—1 |
下列说法中正确的是
| A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池 |
| B.燃料电池是一种高效但是会污染环境的新型电池 |
| C.化学电池的反应基础是氧化还原反应。 |
| D.铅蓄电池放电的时候正极是Pb ,负极是PbO2 |
最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下: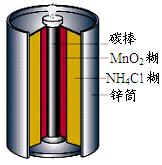
E极:2MnO2+2H2O+2e-="==" 2MnO(OH)+2OH-
F极:Zn+2NH4Cl -2e-===Zn(NH3)2Cl2+2H+
总反应式:2MnO2+Zn+2NH4Cl ="==" 2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是
| A.E极是电池的正极,发生的是氧化反应 |
| B.F极是电池的负极,发生的是氧化反应 |
| C.从结构上分析,锌锰电池应属于可充电电池 |
| D.锌锰电池内部发生的氧化还原反应是可逆的 |
下列烧杯中盛放的都是稀硫酸,不能构成原电池的是