某兴趣小组在实验室用铜和硫酸为原料,采用多种方法制取硫酸铜,制备方法如下:
方法一
⑴甲同学取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到白色沉淀。甲同学为了验证其中白色沉淀的主要成分,设计下列实验。
实验步骤:倾倒掉上层液体后,向所得白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:白色物质溶解,溶液变为蓝色。
实验结论:所得白色固体的化学式为 。
(2)乙同学与甲同学做相同的实验,还观察到加热过程中,试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失,同时产生能使品红溶液褪色的气体,淡黄色固体消失的原因是(用化学反应方程式回答) 。直到最后反应完毕,发现试管中还有铜片剩余。
方法二
(3)丙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O。
2CuO,CuO+H2SO4=CuSO4+H2O。
对比甲的方案,你认为丙同学的优点是①_________________________,②_ 。
方法三
⑷丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色,写出反应的化学反应方程式 。
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为。
(2)混合①中使用冰水的目的是。
(3)操作Ⅱ和操作Ⅲ的名称分别是、。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为,若假设成立可观察到的现象为。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为。
某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;
(一)实验目的:测定铜粉(含炭)样品中铜的质量分数
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰。浓硫酸等
(三)实验内容:
在答题卡上按完成下表空白处内容
| 步骤 |
实验过程 |
实验现象 |
有关化学方程式 |
| 1 |
 |
 |
|
| 2 |
在C中加入样品W克,D中装入碱石 灰后并称量为m1克。连接好仪器,打开A的活塞,慢慢加溶液。 |
||
| 3 |
对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: |
||
| 4 |
冷却后,称量D的质量为m2克。 |
 |
 |
(四)计算:样品中铜的质量分数=______________(用含W、m1.m2的代数式表示)
(五)问题和讨论:
该小组重复测定了三次,得到铜的质量分数的数据存在较大的偏差,你认为原因可能是。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: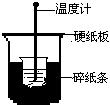
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)大烧杯上如不盖硬 纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由_________________________________。
《硫酸铜晶体里结晶水含量的测定》是中学化学中的重要实验,请回答下列该实验的相关问题。
(1)实验中能直接加热的仪器名称为____________;进行的称量操作至少为________次。
(2)下列操作会引起测定结果偏高的是__________________
| A.加热时温度过高CuSO4发生分解 | B.加热后在空气中冷却再称量 |
| C.加热过程中有晶体溅出 | D.晶体部分风化 |
二氯化二硫(S2C12)在工业上用于橡胶的硫化。为了在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:
①在110℃~ 140℃时,将干燥的氯气与硫反应可得到S2C12的粗产品。 ②有关物质的部分性质如下表:
②有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
| S |
112.8 |
444.6 |
略 |
| S2C12 |
-77 |
137 |
S2C12遇水生成HCl、SO2、S,300℃以上完全分解; S2C12 + C12 2SCl2 2SCl2 |
| SCl2 |
-121 |
59.6(分解) |
设计实验装置如下图: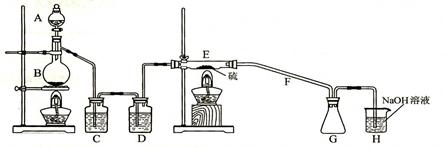
(1)仪器A,B的名称分别为______________,______________。
A中发生反应的离子方程式为。
C中的试剂名称是______________;仪器D的作用是。
(2)上图中装置不够完善,请你提出改进意见;
利用改进后的正确装置进行实验,请回答下列问题:
(3)E中反应的化学方程式为_____________________________________________。
(4)如果在加热E时温度过高,对实验结果的影响是_________________________,
在F中可能出现的现象是_________________________________________。
(5)S2C12粗品中可能混有的杂质是、、___________,为了提高S2C12的纯度,关键的操作是控制好温度和______________________。