某校探究学习小组同学用含有少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取“化学纯”级的NaCl,实验前他们设计了如下方案(框图)。 
(1)请写出操作第④、⑤步所加试剂名称及第⑥步操作名称:④ ,⑤ ,⑥ ;
(2) 沉淀混合物C的化学成分有(用文字和化学式表示): ;
(3)写出第⑤步操作中可能发生反应的离子方程式:
;
(4)如何用最简单方法检验第⑤步实验是否达到了目的:
;
(5)你认为该设计里哪些步骤调换后不影响实验结果: ;
(6)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:
。
以下是某学习小组对乙二酸的某些性质进行研究性学习的过程:
[研究课题]探究乙二酸的某些性质
[查阅资料]乙二酸(HOOC-COOH)俗称草酸,草酸晶体的化学式为H2C2O4·2H2O;草酸在100℃时开始升华,157℃时大量升华,并开始分解;草酸蒸气在低温下可冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
[提出猜想]
猜想一:乙二酸具有不稳定性
根据草酸晶体的组成,该小组同学猜想其受热分解产物为CO、CO2和H2O。
设计方案:
(1)请用下列装置组成一套探究并验证其产物的实验装置(草酸晶体分解装置略,连接导管略去)。
请回答下列问题:
①装置的连接顺序为:A→( )→D→( )→B→D。
②装置中碱石灰的作用是。实验时,在点燃B处酒精灯之前,应进行的操作是。检验产物中CO的实验现象是。③整套装置存在不合理之处为。
猜想二:乙二酸具有弱酸性
设计方案:
(2)该小组同学为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是______(填字母)。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定相同浓度的草酸和硫酸溶液的pH
C.测定草酸钠(Na2C2O4)溶液的pH
D.将草酸溶液加入Na2CO3溶液中,有CO2放出
(3)该小组同学将2.52 g草酸晶体M(H2C2O4·2H2O)=126g/mol加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,使用pH计测定反应后溶液,结果呈酸性,则溶液中各离子的浓度由大到小的顺序为。
猜想三:乙二酸具有还原性设计方案:
(4)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。该反应的离子方程式为。
(本题共13分)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,为白色或黄色结晶粉末或小结晶,带有强烈的SO2气味,溶于水即生成NaHSO3。实验室可利用二氧化硫与亚硫酸钠反应制备焦亚硫酸钠。某研究小组进行如下实验:实验一:焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有黄色晶体析出。
33.装置I中产生气体的化学方程式为。
34.要从装置II中获得已析出的晶体,在实验室中需要使用到的玻璃仪器是:。
35.装置III用于处理尾气,防止污染环境。下列装置中,可选用的最合理装置(夹持仪器已略去)为(填序号)。
实验二:焦亚硫酸钠的性质
36.将Na2S2O5溶于水配成溶液,
(1)欲证明所得溶液中的离子浓度大小关系:c(SO32—)>c(H2SO3),下列选项中可采用的实验方法是。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
f.加入BaCl2溶液
(2)检验Na2S2O5晶体在空气中已被氧化的实验方案是。
实验三:葡萄酒中抗氧化剂残留量的测定
37.葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果(填“偏高”“偏低”或“不变”)。
乙酰苯胺可用作止痛剂、退热剂、防腐剂和染料中间体,实验室制备乙酰苯胺反应原理和有关数据如下: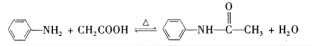
| 名称 |
相对分子质量 |
性状 |
密度(g/cm3) |
沸点/℃ |
溶解度 |
|
| 苯胺 |
93 |
无色油状液体具有还原性 |
1.02 |
184 |
微溶于水 |
均易溶于乙醇、乙醚 |
| 乙酸 |
60 |
无色液体 |
1.05 |
118 |
易溶于水 |
|
| 乙酰苯胺 |
135 |
白色晶体 |
1.22 |
304 |
微溶于冷水、溶于热水 |
实验步骤:
在50ml圆底烧瓶中加入无水苯胺5ml.,冰醋酸7.5mL,锌粉0.lg,按下图安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,调节加热温度,使柱顶温度控制在105℃左右,反应约60~ 80nun,当反应基本完成时,停止加热.
在搅拌下,趁热将烧瓶中的物料倒人盛有l00mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品.将粗品重结晶,抽滤,晾干,称重,计算产率,注:D为刺形分馏柱,用于沸点差别不太大的混合物的分离.
请回答下列问题:
(1)仪器B的名称。
(2)装置图中加热可用(填“水浴”或“油浴”)。
(3)实验中加入锌粉的目的是。
(4)为何要控制分馏柱上端的温度在105℃左右。
(5)通过观察到,现象可判断反应基本完成,反应结束后须立即倒入事先准备好的冰水中的原因。
(6)洗涤乙酰苯胺粗品最合适的试剂是。
a.用少量冷水洗
b.用少量热水洗
c.先用冷水洗,再用热水洗
d.用酒精洗
(7)该实验最终得到纯品1.8 g,则乙酰苯胺的产率是。
草酸(H2C2O4)是一种白色固体,熔点是101℃~102℃,大约在157℃时开始升华,189.5℃分解,是常用的工业原料。利用草酸和含镍废料(镍铁钙镁合金为主)制取草酸镍。已知草酸的钙、镁、镍盐难溶于水。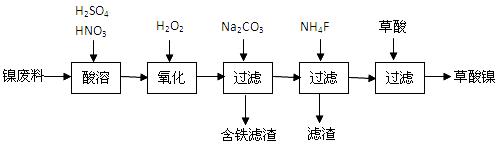
(1)生产过程中多次进行过滤。实验室进行过滤操作中用到铁架台、烧杯、玻璃棒,还需要;
(2)加入过氧化氢后缓慢加入碳酸钠溶液调pH至4.0 ~ 4.5左右,加入碳酸钠溶液的作用是,
再加入NH4F的目的是;
(3)用下图所示仪器连接组成的装置来探究草酸受热分解的产物。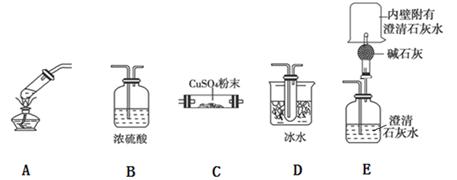
①实验中,观察到无水硫酸铜变蓝,洗气瓶中内澄清石灰水变浑浊,在干燥管尖嘴处点燃逸出的气体,烧杯内壁附有的澄清石灰水变浑浊,证明产物中有______________;E装置略作改动也能证明产物中无氢气,证明方法是______________________________;
②装置的连接顺序为__________________,C装置的作用是____________________。
(13分)重铬酸钾是一种重要的氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3、SiO2、Al2O3)为原料生产。实验室模拟工业法用铬铁矿制重铬酸钾(K2Cr2O7)的主要工艺如下: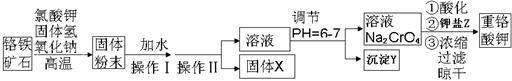
试回答下列问题:
(1)以上工艺流程所涉及元素中属于过渡元素的有。铁在周期表的位置是。
(2)操作Ⅱ的名称是。
(3)固体X的主要成分是___________,沉淀Y的主要成分是。
(4)流程中①酸化所用的酸和②钾盐Z最合适的是(填符号)________,
| A.盐酸和氯化钾 | B.硫酸和氯化钾 |
| C.硫酸和硫酸钾 | D.次氯酸和次氯酸钾 |
酸化反应的离子方程式为。
(5)FeO·Cr2O3与氯酸钾、氢氧化钠高温反应化学方程式:。