(1)0.5 mol H2O的质量为_______________,其中含有_______________个水分子,共有_______________个原子。
(2)质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是_______________;在相同温度和相同压强条件下,体积最大的是_______________,体积最小的是_______________。
(1)写出下列化学反应的离子方程式
①氢氧化钡溶液和硫酸铜溶液的反应
②碳酸钠和足量稀硫酸的反应
(2)根据下列离子方程式,各写一个符合条件的化学 方程式
方程式
①Fe+2H+====Fe2++H2↑
②HCO3-+ H+====CO2↑+ H2O
(1)在氧化还原反应中,反应物中某元素化合价升高,则该反应物发生_______反应(填
“氧化”或“还原”,下同),做_______剂;从电子转移角度分析,________剂得到电子,发生________反应。
(2)火药 是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:
是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:
2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是(填元素符号),
还原剂是(填化学式,下同),氧化产物是。
有下列物质:①Fe ②CO2 ③H2SO4④Ba(OH)2溶液 ⑤氨水 ⑥NaHSO4
其中属于酸的是 (填序号,下同),属于盐的是 ,属于氧化物的是,属于电解质的是 ,可导电的是。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回 答:
答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=。平衡时H2的转化率为%。
2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=。平衡时H2的转化率为%。
(2)平衡后,若提高H2的转化率,可以采取的措施有。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g) 2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
| T/ ℃ |
200 |
300 |
400 |
| k |
K1 |
K2 |
0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1_______ K2 (填“<”“> ”或“=”);
”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号字母)
A、容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B、v(N2)正=3 v(H2)逆
C、容器内压强保持不变
D、混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2的物质的量分别为3mol、2 mol和1 mol时,则该反应的
N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2的物质的量分别为3mol、2 mol和1 mol时,则该反应的
v(N2)正______v(N2)逆 (填“<”“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是_________。
A、化学反应速率理论可指导怎样在一定时间内快出产品
B、勒夏特列原理可指导怎样使用有限原料多出产品
C、催化剂的使用是提高产品产率的有效方法
D、正确利用化学 反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
化学电池在通讯、交通及日常生活中有着广泛的应用。
⑴下列相关说法正确的是
A.通过某种电池单位质量或单位体积所能输出能量的多少 ,可以判断该电池的优劣
,可以判断该电池的优劣
B.二次电池又称充电电池或蓄电池,这类电池可无限次重复使用
C.除氢气外,甲醇、汽油、甲烷、乙烷、氧气等都可用作燃料电池的燃料
D.近年来,废电池必须进行集中处理的问题被提到议事日程,其首要原因是电池外壳的金属材料需要回收
⑵目前常用的镍(Ni)镉(Cd) 电池,其电池总反应可表示为:
电池,其电池总反应可表示为:
2Ni(OH)2+Cd(OH)2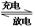 Cd+2NiO(OH)+2H2O
Cd+2NiO(OH)+2H2O
已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,下列说法正确的是:
A.以上反应是可逆反应 B.反应环境为碱性
C.电池放电时Cd作负极 D.该电池是一种二次电池
⑶在宇宙飞船和其它航天器上经常使用的氢氧燃料电池是一种新型电池,其结构如图所示:a、b两个电极均由多孔的炭块组成,通入的氢气和氧气由孔隙中逸入,并在电极表面发生反应而放电。
①a电极是电源的 极
极
②若该电池为飞行员提供了36Kg的水,则电路中通过了mol电子。