【化学选修3物质结构与性质】有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小。围绕上述元素,回答下列问题:
(1)Q的电子排布图为 ,YQ3中心原子的杂化类型为 ,除X外,其余元素的第一电离能由小到大顺序为 (元素符号回答)。
(2)X2P和ZP2固态时均为分子晶体,但熔点X2P比ZP2高得多,原因是 。
(3)固体A是离子晶体,结构类似于CsCl,组成中含W的质量分数为73.7%,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,该物质适当加热就分解成两种单质气体。该物质的电子式 ,其与水反应的化学方程式为 。
(4)Z单质有三类异形体,其中一种骨架型原子晶体的立方晶胞如图,计算晶体中Z原子的空间利用率为 ( )。
)。

(1)给下列物质命名或写出结构简式:
(2)葡萄糖的结构简式
(3)乙酸与CH3CH218OH发生酯化反应的化学方程式,并注明反应条件
填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:;
(2)周期表中最活泼的非金属元素位于第族;
(3)所含元素种类是8种的周期是第、周期。
(4)氯元素在周期表中位于第周期第族。氯的最高价氧化物的化学式为,最高价氧化物的水化物的化学式为__________。
(5)物质在下列变化过程中克服的是:①共价键 ②离子键。(填序号)
HCl溶于水电解熔融NaCl制Na
电解水分解生成O2和H2
(6)在下述反应中,属于取代反应的是;属于氧化反应的是;属于加成反应的是。
①乙烯使溴水褪色 ②乙烯使酸性高锰酸钾溶液褪色③苯与浓硝酸制硝基
(10分) A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。 (1)A为,B为,C为。D的最高价氧化物的水化物是。
(1)A为,B为,C为。D的最高价氧化物的水化物是。 (2)写出A、B的化合物与E反应的化学方程式:
(2)写出A、B的化合物与E反应的化学方程式:
 (3)A、B两元素形成化合物属(“离子”或“共价”)化合物。
(3)A、B两元素形成化合物属(“离子”或“共价”)化合物。 (4)写出D的最高价氧化物的水化物和A反应的化学方程式:
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:
(14分)
 下表是元素周期表的一部分,请回答有关问题:
下表是元素周期表的一部分,请回答有关问题:
主族 周期 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
||||
| 4 |
⑨ |
④ |
⑩ |
 (1)表中化学性质最不活泼的元素,其原子结构示意图为。
(1)表中化学性质最不活泼的元素,其原子结构示意图为。 (2)表中能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的
(2)表中能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的 质与⑨最高价氧化物的水化物反应的化学方程式
质与⑨最高价氧化物的水化物反应的化学方程式 (3)④元素与⑦元素形成化合物的电子式
(3)④元素与⑦元素形成化合物的电子式 (4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(填化学式)。 (5)③元素与⑩元素两者核电荷数之差是。
(5)③元素与⑩元素两者核电荷数之差是。 (6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。


| 实验步骤 |
实验现象与结论 |
      |
(9分)
 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。

| 实验方案(I) |
实验现象(Ⅱ) |
答案(III) |
|
| 实验方案I |
实验现象II |
||
1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 水反应,再向反应液中滴 加酚酞 加酚酞 |
A浮与水面,剧烈反应,放出气体, 熔成—个小球,在水面上无定向移 熔成—个小球,在水面上无定向移 动,随之消失,溶液变红色。 动,随之消失,溶液变红色。 |
1 |
|
2.向新制的H2S饱和溶 液中滴加新制的氯水 液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 烧,溶液变成浅红色 |
2 |
|
3.钠与滴有酚酞的冷水反应 |
C.反应不十分剧烈,产生的气体 可以在空气中燃烧 可以在空气中燃烧 |
3 |
|
4.镁带与2mol/L的盐酸 反应 反应 |
D.剧烈反应,产生的气体可以在 空气中燃烧 空气中燃烧 |
4 |
|
5铝条与2mol/L的盐酸 反应 反应 |
E.生成白色絮状沉淀,继而沉淀 消失 消失 |
5 |
|
6.向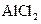 溶液中滴加 溶液中滴加 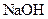 溶液至过量 溶液至过量 |
F.生成淡黄色沉淀 |
6 |
(2)通过以上实验分析了同周期元素的符号,从实验结果可以得出的结论是。