丁苯橡胶可用煤炭为主要原料来制得:
1,3—丁二烯与苯乙烯一定条件下可加聚生成丁苯橡胶。请回答:
(1)煤可通过 的方法制得焦炭。
(2)A的结构简式为 ;反应④的反应类型为 。
(3)写出反应③的化学方程式 。
(4)苯乙烯有多种同分异构体,写出两种核磁共振氢谱只有一个波峰的同分异构体的结构简式 、 。
石墨在材料领域有重要应用。某初级石墨中含
(7.8%)、
(5.1%)、
(3.1%)和
(0.5%)等杂质。设计的提纯和综合应用工艺如下:
(注:
的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入
前,需通一段时间的
,主要目的是 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为 。由气体II中某物质得到水玻璃的化学方程式为。
(3)步骤①为:搅拌、 。所得溶液IV中阴离子有。
(4)由溶液IV生成沉淀V的总反应的离子方程式为 。100
初级石墨最多可获得
的质量为
。
(5)石墨可用于自然水体中铜件的电化学防腐,完成下图防腐示意图,并作相应标注。
用
代替
与燃料
反应,既可以提高燃烧效率,又能得到高纯
,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①
②
③
(1)反应
的
(用
表示)。
(2)反应①~③的平衡常数的对数
随反应温度
的变化曲线见图18.结合各反应的
,归纳
曲线变化规律:
a)
b)
(3)向盛有
的真空恒容容器中充入
,反应①于900 ºC达到平衡,
平衡(
)=8.0×10-5
,计算
的转化率(忽略副反应,结果保留2位有效数字)。
(4)为减少副产物,获得更纯净的
,可在初始燃料中适量加入。
(5)以反应①中生成的
为原料,在一定条件下经原子利用率100%的高温反应,可再生成
,该反应的化学方程式为;在一定条件下
可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为。
不饱和酯类化合物在药物、涂料等领域应用广泛。
(1)下列关于化合物I的说法,正确的是
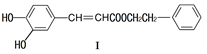
| A. | 与 溶液可能显紫色 |
| B. | 可能发生酯化反应和银镜反应 |
| C. | 能与溴发生取代和加成反应 |
| D. | 1 化合物I最多与2 反应 |
(2)反应①的一种由烯烃直接制备不饱和酯的新方法
化合物II的分子式为。1
化合物II能与
恰好反应生成饱和烃类化合物。
(3)化合物II可由芳香族化合物III或IV分别通过消去反应获得。但只有III能与
反应产生
。III的结构简式为(写1种);由IV生成II的反应条件为。
(4)聚合物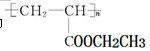 可用于制备涂料。其单体的结构简式为。利用类似反应①的方法仅以乙烯为有机原料合成该单体,涉及的反应方程式为。
可用于制备涂料。其单体的结构简式为。利用类似反应①的方法仅以乙烯为有机原料合成该单体,涉及的反应方程式为。
下列叙述I和II均正确并有因果关系的是()
| 选项 |
叙述I |
叙述II |
| A |
的溶解度大 |
用重结晶法除去 中混有的 |
| B |
难溶于酸 |
用盐酸和
溶液检验
|
| C |
能使酚酞溶液变红 |
可用于设计喷泉实验 |
| D |
能制成澄清石灰水 |
可配制2.0
的
溶液 |
叶酸是维生素
族之一,可以由下列甲、乙、丙三种物质合成。
(1)甲中显酸性的官能团是(填名称)。
(2)下列关于乙的说法正确的是(填序号)。
a.分子中碳原子与氮原子的个数比是7:5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为。
a.含有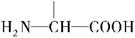 b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):
①步骤I的反应类型是。
②步骤I和Ⅳ在合成甲过程中的目的是。
③步骤Ⅳ反应的化学方程式为。