在2 L密闭容器中发生反应4A(s)+3B(g)=2C(g)+D(g),经2 min,B的物质的量减少0.6 mol,下列对该反应速率表示正确的是
A.在2 min末的反应速率:v (B)=0.3 mol·L-1·min-1
B.用A表示的反应速率为:v (A)=0.4 mol·L-1·min-1
C.用D表示的平均反应速率为:v (D)= 0.05 mol·L-1·min-1
D.分别用B、C表示的反应速率其比值为2∶3
有一瓶14%的KOH溶液,加热蒸发掉100 g水后,变为28%的KOH溶液80 mL,该80 mL溶液的物质的量浓度为( )
| A.5 mol/L | B.6 mol/L |
| C.6.25 mol/L | D.6.75 mol/L |
V LFe2(SO4)3溶液中含有a g SO42-,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量的浓度为( )
A.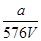 mol·L-1 mol·L-1 |
B.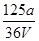 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 |
D.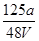 mol·L-1 mol·L-1 |
同体积、同物质的量浓度的BaCl2溶液可分别使同体积的Fe2(SO4)3、ZnSO4、K2SO4三种溶液中的SO42-完全沉淀,则三种硫酸盐中金属离子物质的量浓度之比为( )
| A.1:2:3 | B.1:3:6 |
| C.2:3:6 | D.6:2:1 |
将质量分数为a%、物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使其质量分数为2a%。此时溶液的物质的量浓度为c2 mol·L-1。则c1和c2的关系是( )
| A.c1=2c2 | B.c2<2c1 |
| C.c2>2c1 | D.c2=2c1 |
将5.1 g镁铝合金投入到500 mL 2.0 mol/L的盐酸中,金属完全溶解,再加入4.0 mol/L的NaOH溶液,若要生成的沉淀最多,则应加入NaOH溶液的体积是( )
| A.200 mL | B.250 mL | C.425 mL | D.560 mL |