某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
| 序号 |
A |
B |
烧杯中的液体 |
指针是否偏转 |
| 1 |
Zn |
Cu |
稀硫酸 |
有 |
| 2 |
Zn |
Zn |
稀硫酸 |
无 |
| 3 |
Cu |
C |
氯化钠溶液 |
有 |
| 4 |
Mg |
Al |
氢氧化钠溶液 |
有 |
分析上述数据,回答下列问题:
(1)实验1中由A极流向B极的是 (填“电流”或“电子”);
(2)实验4中电子由B极流向A极,表明负极是 电极(填“镁”或“铝”);电极反应式为: ;
(3)实验3表明 (选填序号);
①铜在潮湿空气中不会被腐蚀 ②铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是 (选填序号)。
①相对活泼的金属一定做负极
②失去电子的电极是负极
③烧杯中的液体,必须是电解质溶液
④浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种能导电的非金属)
(1)下列物质中:互为同素异形体的有(填序号,下同),属于同位素的有。
①液氯②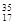 Cl③白磷④氯气⑤红磷⑥
Cl③白磷④氯气⑤红磷⑥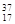 Cl
Cl
(2)下列物质中:只存在共价键的是(填序号,下同),只存在离子键的是,既存在离子键又存在极性共价键的是,既存在离子键又存在非极性共价键的是。
①Ar②CO2③Na2O2④KOH⑤MgBr2⑥NH4Cl⑦CaO⑧H2SO4
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C,D,E。
(2)写出下列反应的化学方程式:
①A和水生成E:。
②B和D生成C:
③Cl2与E的水溶液:
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是________。
| A.煤的形成 | B.原电池工作 |
| C.简单机械织布 | D.我国古代烧制陶器 |
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”可用下图表示。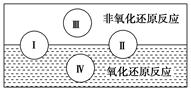
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_________________________,其中水为________剂。
(3)氯化铵常用于焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
________CuO+________NH4Cl ________Cu+______CuCl2+______ N2↑+______H2O。
________Cu+______CuCl2+______ N2↑+______H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
③反应中若产生0.2 mol的气体,则有________ mol的电子转移。
写出下列反应的离子方程式(每小题3分,共18分)
(1)小苏打与烧碱溶液反应:
__________________________
(2)钠和水反应
__________________________
(3)过量的二氧化碳与氢氧化钠
_________________________
(4)NH4HCO3溶液与足量NaOH溶液反应:
__________________________
(5)大理石(CaCO3)与稀HNO3反应:
__________________________
(6)Al与NaOH溶液反应:
___________________________
室安卡因(G)是一种抗心率失常药物,可由下列路线合成;
(1)已知A是 的单体,则A中含有的官能团是_______(写名称)。B的结构简式是_______。
的单体,则A中含有的官能团是_______(写名称)。B的结构简式是_______。
(2)C的名称(系统命名)是_______,C与足量NaOH醇溶液共热时反应的化学方程式是__________。
(3)X是E的同分异构体,X分子中含有苯环,且苯环上一氯代物只有两种,则X可能的结构简式有 、________、________、________。(写出三种即可)
、________、________、________。(写出三种即可)
(4)F→G的反应类型是________。
(5)下列关于室安卡因(G)的说法正确的是________。
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d..属于氨基酸