研究小组欲进行从海水中获取淡水、食盐并提取镁和溴等物质的实验探究。
(1)无需经过化学变化就能从海水中获得的一组物质是 (填序号)。
① Cl2、Br2、I2 ② Na、Mg、Al ③烧碱、氢气 ④食盐、淡水
(2)在生产过程中,从海水中提取镁的流程如下图所示: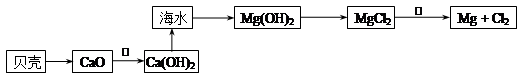
贝壳中的主要成分是:___________(填化学式);反应①属于________反应(填“吸热”或“放热”)。
反应②的化学方程式为 。
(3)实验室从海水样品中提取溴的主要步骤是:向海水样品中通入适量氯气将溴离子氧化,该反应的离子方程式为 ;从反应后的溶液中提取溴单质的实验操作是____________(填实验操作名称)。
(12分)(1)用电子式表示H2O和MgBr2的形成过程
H2O MgBr2
(2)写出CO2、Na2O2、H2O2的电子式:
CO2Na2O2H2O2
(3) H2O以键结合,MgBr2以键结合。NaOH以键结合,Na2O2以键结合(填极性键、非极性键、离子键)
(4)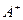 、
、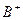 、
、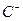 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①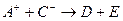 ;②
;②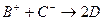 。
。 据此,回答下列问题:
据此,回答下列问题:
①写出①反应的离子方程式。
②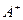 和C-的电子式
和C-的电子式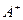 ____________、C-____________。
____________、C-____________。
X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物时,其电子式为,若XY2为共价化合物时,其形成过程的电子式为。
短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
| A |
C |
|
| B |
(1)A的氢化物分子式为,电子式为。
(2)B的元素符号为,原子结构示意图为,在周期表中位于第周期族;
(3)C的单质分子式为,C的单质溶于水所得溶液叫。
据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
(1)下列有关O4的说法正确的是:
| A.O4分子内存在极性共价键 |
| B.合成O4的反应可看作核聚变反应,即不属于化学变化 |
| C.O4与O3、O2都是氧的同素异形体 |
| D.O4将来可用作更强有力的火箭推进的氧化剂 |
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的: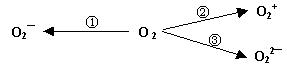
上述反应中,(填序号)相当于氧分子的氧化;(填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:__________________。
有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8;E与B的质量比为1:1。试回答:
(1)写出D原子的电子排布式────────────────
(2)写出AB2的结构式━━━━━━━━━━━━━━━━━━━━
(3)用电子式表示AE2的 形成过程━━━━━━━━━━━━━━━━━━━━
形成过程━━━━━━━━━━━━━━━━━━━━
(4)B、C两元素的第一电离能大小关系为:───>────(填写元素符号),原因是─────────────────────────────────────。
(5)根据VSEPR模型预测C的氢化物的立体结构为──────────,中心原子C的轨道杂化类型为────────。
(6)C的单质中π键的数目为──────,B、D两元素的气态氢化物的稳定性大小关系为:───>────(填写化学式)。