向100mL18mol/L的H2SO4溶液中加入足量的铁片加热。充分反应后,产生的气体在标准状况下的体积为(提示:2Fe+6H2SO4(浓)  Fe2(SO4)3+SO2↑+6H2O)。
Fe2(SO4)3+SO2↑+6H2O)。
| A.小于20. 16 L | B.等于20. 16 L |
| C.介于20. 16 L和40. 32 L之间 | D.等于40. 32 L |
已知25℃时:
① NH4+ (aq)+OH-(aq)=NH3·H2O(aq) ΔH="a" kJ·mol-1
② NH4+ (aq)+H2O(1)  NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,下列有关说法正确的是
NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,下列有关说法正确的是
A.水电离过程的热化学方程式可表示为:H2O(1)  H+(aq)+OH-(aq) ΔH=(a-b)KJ/mol H+(aq)+OH-(aq) ΔH=(a-b)KJ/mol |
| B.当滴入10mL盐酸时,溶液中:c(NH4+)+c(NH3·H2O)=2c(Cl-) |
| C.随着盐酸的逐滴加入,水电离的c(OH-)总是逐渐减小 |
| D.当滴入20 mL盐酸时,溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
科学家们在研制一种吸气式的锂一空气电池,工作时吸收空气中的氧气在多孔金制成正极表面上反应。总反应可表示为2Li+O2 Li2O2,下列有关说法正确的是
Li2O2,下列有关说法正确的是
| A.充电时,多孔金制成的电极外接电源负极 |
| B.放电时,吸收空气中22.4L的O2,就有2mole-从电池负极流出 |
| C.放电时,Li+从负极向正极移动 |
| D.该电池可使用含Li+的水溶液作电解质溶液 |
仅用下表提供的仪器和药品,就能达到相应实验目的是
| 编号 |
仪器 |
药品 |
实验目的 |
| A |
托盘天平(带砝码)、胶头滴管、量筒、烧杯、约匙、玻璃棒 |
NaCl固体、蒸馏水 |
配制一定质量分数的NaCl溶液 |
| B |
分液漏斗、烧瓶、锥形瓶、 导管及橡皮塞 |
盐酸、大理石、碳酸钠溶液 |
证明非金属性:Cl>C>Si |
| C |
酸式滴定管、胶头滴管、铁架台(带铁夹) |
已知浓度的盐酸、待测NaOH溶液 |
测定NaOH溶液的物质的量浓度 |
| D |
烧杯、分液漏斗、胶头滴管、铁架台 |
待提纯的A1C13溶液、NaOH溶液 |
提纯混有MgC12杂质的AlCl3溶液 |
最近,各国科学家联合研制成功一种新型催化剂,可在常压下将二氧化碳与氢气混合转化为甲烷。在VL容器中进行该转化,相关情况如图所示。下列有关说法不正确的是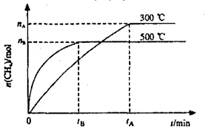
A.101KPa、120℃时,该反应的平衡常数表达式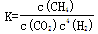 |
| B.断裂lmolC=O、2molH—H所吸收的能量小于形成2molC—H、2molO—H所释放的能量 |
C.300℃时,从反应开始达到平衡的这段时间,化学反应速率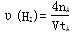 |
| D.其它条件不变,减小容器体积,二氧化碳的平衡转化率增大,平衡常数不变 |
常温下,下列各组微粒在指定溶液中一定能大最共存的是
| A.由水电离的c(H+)=1×l0-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| B.pH=1的溶液中:K+、Cr2O72-、SO42-、CH3CHO |
| C.加石蕊呈蓝色的溶液中:Na+、K+、AlO2-、NO3- |
| D.通入足量CO2后的溶液中:NH4+、Na+、C6H5O-、Cl- |