短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4,下列说法正确的是( )
| A.W、X、Y、Z的原子半径大小顺序是:W>X>Y>Z |
| B.Y的最高价氧化物对应水化物的酸性比Z的最高价氧化物对应水化物的酸性更强 |
| C.Y和Z形成的分子的空间构型可能是正四面体 |
| D.工业上用电解熔融的X和Z两元素组成的化合物来制取X的单质 |
下列离子方程式正确的是
| A.在硫酸铜溶液中加入硫化钠水溶液:Cu2++S2- +2H2O===Cu(OH)2↓ + H2S↑ |
| B.在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ ClO-===Cl-+ 2H++ SO42- |
| C.在碳酸氢镁溶液中加入过量氢氧化钠溶液: Mg2++ 2HCO3-+ 4OH-===Mg(OH)2 ↓+ 2CO32-+ 2H2O |
| D.氮化镁加入过量稀盐酸中:Mg3N2+ 6H+===3Mg2++ 2NH3↑ |
设NA代表阿伏加德罗常数的数值。下列说法中正确的是
| A.0.1 mol Cl2与足量NaOH溶液反应,转移电子数为0.2 NA |
| B.0.1 mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15 NA |
| C.常温常压下,100 mL 0.5 mol/L的乙二酸溶液中,总的离子数目大于0.15 NA |
| D.10 g D2O所含的中子数为4 NA |
下列化学用语错误的是
A.氨分子的结构式: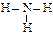 |
B.阴离子CH3-的电子式: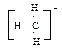 |
C.Mg2+的结构示意图: |
D.乙烯的最简式:CH2 |
有A、B、C、D四种短周期元素,原子半径大小顺序为:D>A>B>C。已知:C原子的最外层电子数是次外层的3倍,D原子的核外电子数比C原子的核外电子数多4,B、C两元素在周期表的位置相邻,且B和C所构成的阴离子电子总数为32 ,A元素最高价氧化物对应水化物的分子式为HXAOY,其分子中A的原子核外电子数比氢、氧原子的核外电子总数之和少16。HXAOY的相对分子质量比A的气态氢化物的相对分子质量多64。试回答下列问题:
⑴写出元素符号:A,B,C。
⑵A、D两元素组成的化合物的晶体类型是,其电子式为。
工业接触法制硫酸的吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到58.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果如下表;
| 不同质量铵盐/g |
25.00 |
50.00 |
75.00 |
100.00 |
| 浓硫酸增加的质量/g |
相同 |
相同 |
1.70 |
0 |
试计算:该铵盐中氮元素的质量分数是
| A.12.15% | B.21.50% | C.14.56% | D.无法确定 |