归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。
②pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1。
③在Na2CO3和NaHCO3溶液中均存在下列关系c(Na+)+c(H+)=c(OH-)+c(HCO3‑)+2c(CO32-)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;
则三者关系为:Ka·Kh=Kw
⑥反应A(g) 2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是
2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是
| A.①②③⑥ | B.③④⑤⑥ | C.②④⑤⑥ | D.①③④⑤ |
常温下的下列溶液,有关说法正确的是
A.某酸H2A的钠盐NaHA溶液中:c(A2-) < c(H2A),则该溶液的pH>7
B.1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
C.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
D.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
| A.该溶液的pH=4 |
| B.升高温度,溶液的pH增大 |
| C.此酸的电离平衡常数约为1×10-7 |
| D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
降低温度时,下列数据不一定减小的是
| A.化学反应速率v |
| B.溶度积常数Ksp |
| C.水解平衡常数Kh |
| D.水的离子积常数Kw |
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
| A.①② | B.①③ | C.②④ | D.③④ |
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则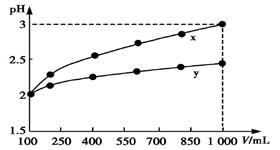
| A.x为弱酸,Vx<Vy | B.x为强酸,Vx>Vy |
| C.y为弱酸,Vx<Vy | D.y为强酸,Vx>Vy |