氯、溴、碘、钠、镁、锰、锂、铀等元素在海洋中被富集。海洋开发利用和维权是国家战略。
(1)以上元素在海水中的存在形态是___________(选填①游离态②化合态③不确定)
(2)以下变化属于化学变化的是__________________________:
①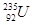 发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
(3)由氯气和晒盐后的卤水制取液溴的离子方程式______________________________;由石灰乳和卤水沉淀出镁元素的离子方程式_____________________________________;由海带灰可浸出KI,由某种矿盐可浸出KIO3,二者在盐酸中反应可生成碘单质,反应的离子方程式__________________________________。
(4)工业由氯化钠制取金属钠的化学方程式为____________________________;工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是_______________________
(5)海底富集多种矿物结核,锰结核是其中的一种。锰结核中主要含有MnO2和Fe2O3。一种质量比约为m(Mn):m(Fe)=55:448的合金钢(其它元素略),具有抗御激烈冲击和磨损的能力,可做航母甲板等。欲通过铝热反应炼得这样的合金,MnO2、Fe2O3、Al的投料比(按物质的量之比)约为_______________。
氢能源是一种重要的清洁能源。现有两种可产生H2的固体化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)乙的电子式是__________。
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是。
(3)乙在加热条件下与CuO反应可生成Cu和气体单质丙,写出该反应的化学方程式。
(4)甲与乙之间能发生反应产生H2,判断理由是。
X、Y、Z、V、W是元素周期表前四周期中的五种常见元素,其相关信息如下表;
| 元素 |
相关信息 |
| X |
X是形成化合物种类最多的元素,它的一种气态氧化物能产生温室效应 |
| Y |
Y是地壳中含量最多的元素 |
| Z |
Z和Y形成的一种化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气的来源 |
| V |
V的单质是淡黄色固体,是黑火药的一种主要成分 |
| W |
W的单质是人们最早发现和使用的金属之一 |
(1)X位于第___周期____族。
(2)写出Z2Y2与水反应的离子方程式 。
(3)X和V形成的化合物是一种无色液体,其合成方法之一是一定条件下用含氢质量分数最大的有机物和V的单质为原料,同时生成一种臭鸡蛋气味的气体。请写出化学反应方程式 。
(4)已知:W2Y3(s)+3XY(g)=2W(s)+3XY2(g)△H=–26.7kJ·mol-1
3W2Y3(s)+XY(g)=2W3Y4(s)+XY2(g)△H=–50.75 kJ·mol-1
W3Y4(s)+XY(g)=3WY(s)十XY2(g)△H=–36.5 kJ·mol-1
则相同条件下,反应WY(s)+XY(g)=W(s)+XY2(g)的△H= 。
为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:
0.01mol/L醋酸溶液、0.1mol/L醋酸钠溶液、pH=3的盐酸、pH=3的醋酸、醋酸钠晶体、氯化钠晶体、甲基橙、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)
(2)乙取出10ml0.10mol/L的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1000mL,在用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是(用“等式”或“不等式”表示)
(3)丙取出10ml0.10mol/L醋酸溶液,滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,你认为这一方法能否证明醋酸是弱电解质?(填“能”或“不能”)。
(4)丁用pH试纸来测定0.1mol/L醋酸钠溶液的pH值,发现0.1mol/L醋酸钠溶液的pH值为14,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)。
(5)戊将pH=3醋酸和盐酸,各取10ml,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)。
(6)己将pH=3醋酸和盐酸,分别加入相应的钠盐固体,醋酸的PH变化大,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)。
(7)庚取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)。
(1)①pH= a的CH3COOH溶液稀释100倍后所得溶液pHa +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH7(填“>”或“<”);
(2)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有和 。(写化学式)
求下列混合后溶液的pH:(lg2=0.3 lg5=0.7)
(1)把pH=2和pH=4的两种强酸溶液等体积混合,其pH=_______。
(2)把pH=12和pH=14的两种强碱溶液等体积混合,其pH=_________。
(3)把pH=2的H2SO4溶液和pH=10的NaOH溶液等体积混合,其pH=_______。