仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图2、图3)就能实现相应实验目的是
| 选项 |
A |
B |
C |
D |
| 实验目的 |
除去KCl中少量MnO2 |
用10mol•L-1盐酸配制100mL 0.1mol•L-1盐酸 |
用NaCl溶液制备氯化钠晶体 |
除去C2H4中少量SO2 |
| 实验仪器 |
烧杯、玻璃棒、分液漏斗 |
100mL容量瓶、玻璃棒、烧杯 |
 |
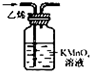 |
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应极小,因而被广泛适用于敏感细菌所致的各类感染病的治疗。下列对头孢羟氨苄的说法中正确的是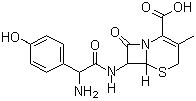 ·H2O
·H2O
| A.头孢羟氨苄的化学式为C16H16N3O5S·H2O |
| B.在催化剂存在的条件下与氢气发生加成反应,1mol头孢羟氨苄消耗7molH2 |
| C.头孢羟氨苄与氯化铁溶液混合显紫色 |
| D.头孢羟氨苄能在空气中稳定存在 |
将1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672ml气体(标准状况),将盛有此气体的容器倒扣在水中,通入少量氧气,最后剩余气体224ml(标准状况)。则通入的氧气在标准状况下的体积为
| A.504ml | B.168ml | C.336ml | D.224ml |
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面。下表中对实验现象所做的解释正确的是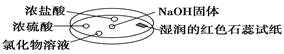
| 选项 |
实验现象 |
解释 |
| A |
浓盐酸附近产生白烟 |
NH3与HCl气体反应生成了NH4Cl固体 |
| B |
浓硫酸附近无明显现象 |
NH3与浓硫酸不发生反应 |
| C |
氯化物溶液变浑浊 |
该溶液一定是AlCl3溶液 |
| D |
湿润的红色石蕊试纸变蓝 |
NH3是一种可溶性碱 |
下列离子方程式正确的是
| A.向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O →CaCO3↓+2HClO |
| B.1mol的Cl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2→2Fe3++4Cl-+I2 |
| C.碳酸氢钙溶液中加入过量的氢氧化钠溶液: HCO3— + OH—→ CO32— +H2O |
| D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-→3Fe3++NO↑+2H2O |
关于如图装置所示的两个实验,说法正确的是
| A.两个装置中都发生了化学变化,都由化学能转变为电能 |
| B.装置②中电流方向是从Zn经导线流入Cu |
| C.反应开始阶段,两个装置中均有氢气产生 |
| D.电极反应式:阳极 2Cl—-2e-→Cl2↑正极 2H++2e-→H2↑ |