粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:
已知Fe3+、Fe2+ 、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 开始沉淀时的pH |
2.7 |
7.6 |
5.2 |
| 完全沉淀时的pH |
3.7 |
9.6 |
6.4 |
(1)加入3% H2O2之前必须进行操作Ⅱ,操作Ⅱ的名称是 ;
H2O2参加反应的离子方程式为 。
(2)加稀氨水调节pH的目的是 ,pH应调至 范围。下列物质可用来替代稀氨水的是 。
①NaOH ②Fe2O3 ③CuO ④Na2CO3
(3)经操作Ⅰ得到粗胆矾,操作Ⅲ得到精致胆矾。两步操作相同,具体包括 、 、
过滤、 、干燥等步骤。
某科研小组以难溶性钾长石(K2O•Al2O3•6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下: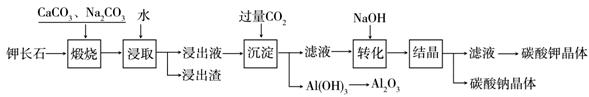
(1)煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式是: 。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O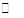 Al(OH)3 + OH— ,
Al(OH)3 + OH— ,
“浸取”时应保持溶液呈 性(填“酸”或“碱”)。
(3)“转化”时加入NaOH的主要作用是 (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是 、 和水。
(5)以Al2O3为原料,以石墨为电极,通过电解法可制得金属铝。电解池中接电源负极的一极的电极反应式是 。长时间电解后,需要更换新的石墨电极的是 极(填“阴”或“阳”)。
(10分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究:
Ⅰ、查阅资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅱ、牙膏样品中碳酸钙的定量测定:
利用下图所示装置(图中夹持仪器略去)进行实验,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
实验步骤:
①如上图所示连接好装置,先检查装置的气密性;
②准确称取牙膏样品的质量4.00g,并在各仪器中加入相应试剂;
③打开弹簧夹甲,缓缓通入空气,然后接上C;
④打开B的分液漏斗滴加盐酸反应,同时再次持续缓缓通入空气;
⑤待B中不再产生气体后停止滴加盐酸;
⑥将C中沉淀过滤、洗涤、干燥,得BaCO3;
⑦称量BaCO3的质量为1.97g。
依据实验过程回答下列问题:
(1)步骤④通过空气的作用有:______________ __、___ __________。
(2)步骤⑥中检验沉淀洗干净的方法是 。
(3)本实验测定得到的样品中碳酸钙的质量分数为 。若采取下列措施,对测定结果的准确度没有影响的是_____________(填标号)。
a.省略步骤③
b.滴加盐酸快一些
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d.多次实验,取平均值计算
(4)有同学认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以准确测定碳酸钙的质量分数。请你说明是否可以并简要说明理由 。
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。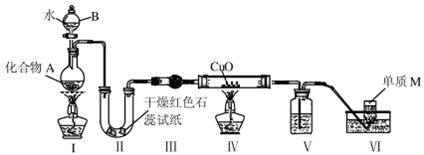
(1)仪器B的名称是____________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为____________;Ⅳ中发生反应的化学方程式为____________________;Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ——Ⅳ—II—Ⅴ——Ⅵ,此时Ⅱ中现象为_____,原因是____________________________________。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M,则A的化学式为__________。
【改编】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下: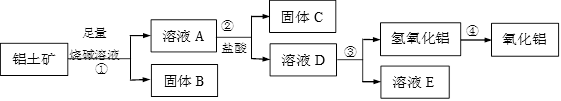
(1)第①步,向铝土矿中加入足量烧碱溶液后,Al2O3发生反应的离子方程式是_______________;固体B是_________;第②步中,涉及到的离子方程式___________________、____________________;
(2)第③步中,生成氢氧化铝最好选用下列试剂中__________试剂(填序号)
| A.二氧化碳 | B.氨气 |
| C.氢氧化钠溶液 | D.盐酸 |
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
《实验化学》甲苯氧化法制备苯甲酸的反应原理如下: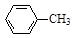 + 2KMnO4
+ 2KMnO4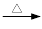
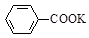 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O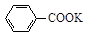 + HCl
+ HCl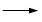
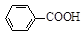 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时,反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。
(1)实验室中实现操作Ⅰ所需的玻璃仪器有 、烧杯;操作Ⅱ的名称为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 。
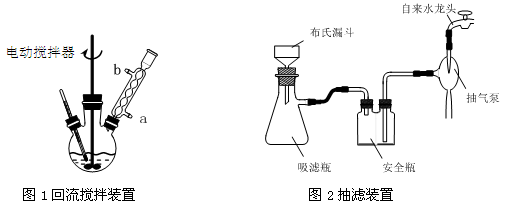
(3)在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是 ;如图2所示抽滤完毕,应先断开 之间的橡皮管。
(4)纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸质量分数为 。