矿物白云母是一种重要的化工原料,其化学式的氧化物形式为
K2O·3Al2O3·6SiO2·2H2O。就其组成元素完成下列填空:
(1)原子最外层有两个未成对电子的元素有_______;属于第三周期的非金属元素是______。
(2)上述元素中,形成的简单离子的半径由大到小的顺序为(Si除外)______________(填离子符号)。
(3)两种金属元素中,金属性较强的元素是_____,能说明这一事实的化学方程式是 (任写一个)。
(4)Al的最高价氧化物对应水化物在酸性溶液中的电离方程式为______________________。
在0.1mol/L的醋酸溶液中,存在平衡:CH3COOH CH3COO- +H+下列说法正确的是()
CH3COO- +H+下列说法正确的是()
| A.加水稀释,中和此溶液所需的0.1mol/LNaOH溶液的体积增大 |
| B.加入固体碳酸钠,平衡正向移动,c(CH3COOH)减小 |
| C.加入固体醋酸钠,平衡逆向移动,c(H+)、c(CH3COO-)均减小 |
| D.加水稀释,电离程度增大,由CH3COOH电离出来的n(H+)增大 |
反应2X(g)+Y(g) 2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是()
2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是()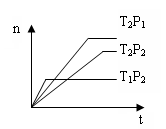
| A.T1<T2,P1<P2 | B.T1<T2,P1>P2 |
| C.T1>T2,P1>P2 | D.T1>T2,P1<P2 |
在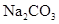 溶液中,下列等量关系成立的是()
溶液中,下列等量关系成立的是()
| A.c(OH-)= c(H+)+c(HCO3-)+2c(H2CO3) |
| B.2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3) |
| C.c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-) |
| D.c(Na+)="2" c(CO32-)+ c(HCO3-)+ c(H2CO3) |
已知 (1)H2(g)+ O2(g)===H2O(g)△H1=a kJ·mol-1
(1)H2(g)+ O2(g)===H2O(g)△H1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g)△H2=b kJ·mol-1 (3)H2(g)+ O2(g)===H2O(l)△H3=c kJ·mol-1
(3)H2(g)+ O2(g)===H2O(l)△H3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l)△H4=d kJ·mol-1
下列关系式中正确的是( )
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
100℃时,NaCl溶液中c(H+)=1×10-6 mol/L。下列说法中正确的是( )
| A.该NaCl溶液显酸性 |
| B.该NaCl溶液显碱性 |
| C.该NaCl溶液中KW=c(H+)·c(OH-)=1×10-14 |
| D.该NaCl溶液中KW=c(H+)·c(OH-)=1×10-12 |