Ⅰ.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入下图装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题: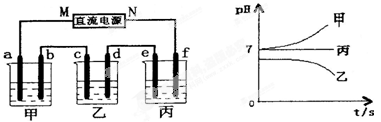
(1)在甲中烧杯中滴加酚酞, 极(填a或b)附近溶液会变红。
(2)写出乙烧杯中发生反应的化学方程式 。
(3)电极f上发生的电极反应式为 。
(4)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是 。
Ⅱ.工业上利用BaSO4制备BaCl2的工艺流程如下: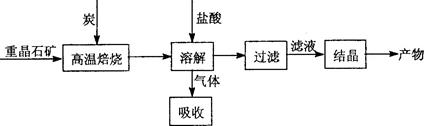
某活动小组的同学在实验室以重晶石(主要成分BaSO4)为原料,对上述工艺流程进行模拟实验。
(1)上述过程中,气体用过量NaOH溶液吸收得到Na2S。Na2S水溶液显碱性的原因是 。(用离子方程式表示)
(2)已知有关反应的热化学方程式如下:
BaSO4(s) +4C(s) 4CO(g)+BaS(s) △H1 = +571.2kJ/mol ①
4CO(g)+BaS(s) △H1 = +571.2kJ/mol ①
C(s) +CO2(g) 2CO(g) △H2 = +172.5kJ/mol ②
2CO(g) △H2 = +172.5kJ/mol ②
则反应BaSO4(s) +2C(s) 2CO2(g) + BaS(s) △H3 =
2CO2(g) + BaS(s) △H3 =
(3)在高温焙烧重晶石过程中必须加入过量的炭,同时还要通入空气,其目的是 。
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: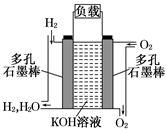
(1) 写出氢氧燃料电池工作时正极电极反应方程式:
___________。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下_______L氧气。
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为_______。电池总离子反应方程式为___________________________。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: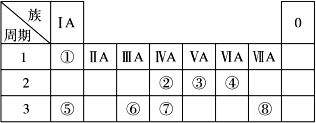
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。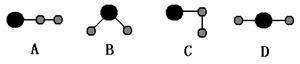
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是()
| A.最高正化合价为+6价, | B.气态氢化物比H2S稳定, |
| C.最高价氧化物的水化物的酸性比硫酸弱, | D.单质在常温下可与氢气化合。 |
(5) 已知X为ⅡA族元素(第一到第七周期),其原子序数为a,Y与X位于同一周期,且为ⅢA族元素,则Y的原子序数b与a所有可能的关系式___________________________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: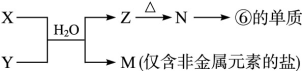
X溶液与Y溶液反应的离子方程式________, M中阳离子的鉴定方法____________。
Ⅰ.为了除去KCl溶液中少量的Mg2+、SO ,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作: 
(1)上述试剂中, B是,C是。
(2)操作Ⅱ的名称是。
(3)加过量A时发生有关反应的离子方程式为 、。
Ⅱ.一份无色稀溶液中可能含有Na+、Fe3+、H+、Mg2+、CO 、OH-、HCO
、OH-、HCO 、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
①用石蕊试纸测溶液的酸碱性,试纸显蓝色;
②取2毫升溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(1)原溶液中一定存在的离子是,一定不存在的离子是。
(2)经过上述操作后,还不能肯定是否存在的离子是。请你设计一个简单的实验方案来判断是否存在这种离子。
Ⅰ.现有八种微粒:Na、Mg2+、Fe2+、Fe3+、S2-、SO2、HCl、H2O,从元素化合价的角度分析,其中只有氧化性的是______,只有还原性的是______,
既有氧化性又有还原性的是___________。
Ⅱ.已知能用氯酸钾与浓盐酸反应制取氯气,其化学方程式如下:
KClO3+6HCl=KCl+3Cl2↑+ 3H2O
⑴用单线桥在上述方程式中标出电子转移的方向和数目。
⑵标况下生成3.36LCl2,转移电子的物质的量为,被氧化的盐酸与未被氧化的盐酸质量之比为。氧化产物与还原产物物质的量之比为。
Ⅰ.某化学兴趣小组对下列三组物质进行研究:
A.HCl H2SO4 H2CO3 HNO3
B.溶液水悬浊液 胶体
C.Na2CO3 NaNO3 AgNO3 Ba(NO3)2
请你帮他们完善下列空白:
| A |
B |
C |
|
| 分类标准 |
含氧酸 |
分散系 |
|
| 不属于该类别的物质 |
Na2CO3 |
Ⅱ.现有下列物质:①铝②氢氧化铁胶体③氯化氢④SO2 ⑤NaHSO4固体⑥Ba(OH)2固体 ⑦稀硫酸⑧醋酸⑨烧碱⑩熔融NaNO3
(1)按物质的分类方法填写表格的空白处:(填编号)
| 分类标准 |
能导电的物质[ |
电解质 |
强电解质 |
| 属于该类的物质 |
(2)①与⑨的溶液反应的离子方程式为
(3)用Fe(OH)3胶体进行下列实验:
(a)将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附的颜色逐渐变 (填“深”或“浅”),这表明 。
(b)向其中逐滴加入过量稀硫酸溶液,现象是_______ _______;
(4)向Ba(OH)2溶液逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,写出此步的离子方程式 。