甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制
备的相关信息如下表:
(1)反应②是____反应(选填“吸热”“放热”)。
(2)据上表信息推导出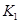 、
、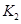 与
与 之间的关系,
之间的关系, =______用
=______用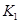 、
、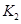 表示)。500℃时测得反应③在某时刻,
表示)。500℃时测得反应③在某时刻, 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时
的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速.v(H2)= 若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。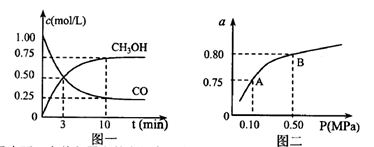
(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是____。(用相应字母表示)
| A.容器中总压强不变 |
| B.混台气体的平均摩尔质量也始终保持不变, |
| C.混合气体的密度不变 |
| D.CO2(g)或CO(g)的浓度不变 |
(5)一定条件下甲醇与一氧化碳反应可合成醋酸。室温下,将a mol/L醋酸溶液与bmol/LNaOH溶液等体积混合。若溶液显中性,则a_________b(选填“>”“<”“=”)。若c(Na+)<c(CH3COO-),则溶液显____性(选填“酸”“碱…中”)。
现有A、B、C三种烃,其球棍模型如下图:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是_____ (填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是_____ ;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____ ,生成水最多的是_____ 。
(4)在120 ℃、1.01×105Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是_____ 。
相对分子质量为72的烷烃,其分子式是____,若此有机物的一氯代物分子中有两个—CH3,两个—CH2—,一个  和一个—Cl,它的可能结构分别是____ 、 ____ 、 ____ 、 ____ 。
和一个—Cl,它的可能结构分别是____ 、 ____ 、 ____ 、 ____ 。
有机物:
(1)该物质苯环上一氯代物有________种;
(2)1 mol该物质和溴水混合,耗Br2的物质的量为________________________mol;
(3)1 mol该物质和H2加成最多需H2________mol;
(4)下列说法不对的是________(填字母序号)。
| A.此物质可发生加成、取代、加聚、氧化等反应 |
| B.和甲苯属于同系物 |
| C.使溴水褪色的原理与乙烯相同 |
| D.能使酸性KMnO4溶液褪色发生的是加成反应 |
有X、Y、Z 3种元素,X是有机化合物中必含的元素,Y是地壳里含量最多的元素,Z是质量最轻的元素。X与Y能结合成两种化合物A和B,A可以燃烧,B不可以燃烧,也不支持燃烧;X与Z结合的最简单的化合物C有可燃性;X、Y与Z三种元素结合的化合物D常用作实验室加热的燃料,D被酸性高锰酸钾氧化生成E。
(1)试判断X、Y、Z分别是(填元素符号):X________,Y________,Z________。
(2)试判断A、B、C、D、E各是什么物质(用化学式表示):
A______________,B___________,C__________,D__________,E______________。
(3)完成化学方程式
①C燃烧的化学方程式: _________________________________________。
②D在铜作催化剂且加热条件下与氧气反应的化学方程式:
________________________________________________________________________。
③D与E在浓H2SO4作催化剂、加热条件下反应的化学方程式:
________________________________________________________________________。
已知有机分子中同一碳原子上接两个羟基是不稳定的,会自动脱水: 。
。
醇的氧化是醇的一个重要化学性质。请回答下列醇氧化的有关问题:
(1)乙醇在铜或银催化下受热和氧气反应的化学方程式:
_________________________________________________________。
(2)有人提出了醇氧化的两种可能过程:
①去氢氧化: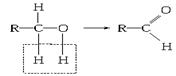
②加氧氧化: (在方框中填写有机物结构简式,说明加氧氧化)。
(在方框中填写有机物结构简式,说明加氧氧化)。
(3)若要证明这两种过程哪一种是正确的,你准备用的方法是________________(回答方法名称即可)。