工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如下图所示。钛铁矿主要成分
为钛酸亚铁( FeTiO3).其中一部分铁元素在风化过程中会转化为+3价。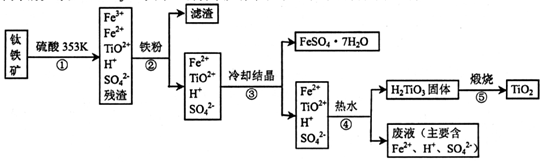
完成下列填空:
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为____。
(2)步骤③中,实现混合物的分离是利用物质的____(填字母序号)。
a.熔沸点差异 b溶解性差异 c氧化性、还原性差异
(3)步骤②、③、④中,均需进行的操作是____(填操作名称)。
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰,则反应的离子方程式为
(5)利用下图装置,石墨作阳极,钛网作阴极,熔融CaF2-CaO做电解质,可获得金属钙,钙再作为还原剂,可还原二氧化钛制各金属钛。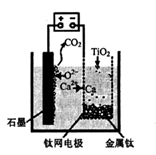
①阳极所发生的反应为________。
②在制备金属钛前后,CaO的总量不变,其原因是____。
(6)_T业上用4.0吨钛铁矿制得1. 6吨的二氧化钛,则钛铁矿中钛元素的质量分数是____。
(假设生产过程中钛没有损失)
氮氧化物进入大气后,可能会形成硝酸型酸雨,因此必须对含有氮氧化物的废气进行处理。
(1)用NaOH可以吸收废气中的氮氧化物,反应的化学方程式如下:2NO2 + 2NaOH  NaNO2 + NaNO3 + H2O反应中,还原剂是 ,NO2 + NO + 2NaOH
NaNO2 + NaNO3 + H2O反应中,还原剂是 ,NO2 + NO + 2NaOH  2NaNO2 + H2O反应中,氧化产物和还原产物之比为 。
2NaNO2 + H2O反应中,氧化产物和还原产物之比为 。
(2)NO2和Br2蒸汽都是红棕色气体,下列可以用来鉴别这两种气体的试剂是 。
| A.用氢氧化钠溶液 | B.淀粉碘化钾溶液 | C.用硝酸银溶液 | D.用蒸馏水 |
(3)汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成两种对大气无污染的气体,该反应的化学方程式为 。
(4)氨气也可用来处理氮氧化物,例如:氨气与二氧化氮反应生成氮气和水,写出该反应的化学方程式: ,若某工厂排出的废气中二氧化氮含量为0.5%(体积分数),处理1000m3(标准状况)这种废气,需要 千克氨气。(结果保留两位小数)
我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应: KIO3 + KI + H2SO4  K2SO4 + I2 + H2O
K2SO4 + I2 + H2O
(1)将上面氧化还原反应的化学方程式配平。
(2)该反应中氧化剂和还原剂的物质的量之比为 。
(3)如果反应中转移0.5mol电子,则生成I2的物质的量为
(4)若要提取生成的碘,所用的萃取剂可以是 (填序号)。
①水②酒精③淀粉溶液④苯
(5)加碘食盐不能长时间炖炒,且应避热保存,主要原因是 。
(1)MgCl2的摩尔质量是 ;0.1mol CO2在标准状况下体积约是 ;0.2 mol·L-1的Cu(NO3)2溶液中NO3-的物质的量浓度是 。
(2)现有以下物质:①熔融NaCl ②液氨 ③醋酸水溶液 ④HCl气体 ⑤酒精(C2H5OH)。请用相应序号填空:能导电的是 ;属于电解质的是 。
(3)CH3COOH的电离方程式为 。
2015年巴黎气候变化大会的主题之一是节能减排,开发新能源以及提高能源的利用率再次受到国际社会的高度关注。
(1)近年我国努力调整能源结构,开发新能源。下列物质中,属于可再生能源的是________(填字母)。
A、氢能 B、天然气 C、石油
(2)已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-l
2C(s)+O2(g)=2COg) △H=-221.0 kJ·mol-l
2CO(g)+O2(g)=2CO(g) △H=-556.0 kJ·mol-l
请回答下列问题:
①l g H2(g)在氧气中完全燃烧生成H2O(g)时放出的热量为______________kJ。
氢气被称为绿色能源的主要原因是____________________。
②若18 g C(s)氧气中不完全燃烧,生成的CO(g)与CO2(g)的物质的量之比为2:l,
则该过程放出的热量比等质量的C(s)在氧气中完全燃烧时要少______________kJ。
③将煤转化为水煤气(H2、CO的混合气)是将煤转化为清洁燃料的方法之一。
则C(s)与H2O (g)反应制备水煤气的热化学方程式为__________________________。
(3)工业上可通过CO(g)和H2(g)化合来制备可再生能源CH3OH(g):
CO(g)+2H2(g)=CH3OH(g) △H=-99 kJ·mol-l
又知该反应中某些物质分子里的化学键的键能数据如下表: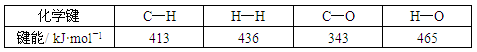
如CO中的C与O之间为叁键连接,则C≡O键的键能为___________kJ·mol-l。
某有机化合物A广泛存在于多种水果中。
(1)经测定,A中仅含有C、H、O三种元素,67 gA在空气中完全燃烧时可生成27g H2O和88 g CO2。则A的实验式或最简式为________________。
若要确定A的分子式,还需要知道A的相对分子质量,测定物质的相对分子质量可以采用___________(填“质谱”或“红外光谱”)法。
经测定A的相对分子质量为134,则A的分子式为_______________。
(2)又知1 molA与足量的NaHCO3溶液充分反应可生成标准状况下的C02气体44.8 L,
l molA与足量的Na反应可生成1.5 mol的H2,则A分子中所含官能团的名称为_________。
(3)若A分子中不存在甲基且有一个手性碳原子,则A的结构简式为________________。
该A在浓硫酸存在下加热,可以生成多种产物,请写出A发生消去反应后所得有机产物的结构简式________________。
(4)A的一种同分异构体B,与A所含官能团的种类和数目均相同,且能催化氧化成醛,则B的1H核磁共振谱图中将会出现__________组特征峰。