铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成:
□Fe2++ □ClO-+ □ = □Fe(OH)3↓+ □C1-+ □ 。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
碳酸锂广泛应用于陶瓷和医药等领域。已知β锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原材料制备Li2CO3的工艺流程如下: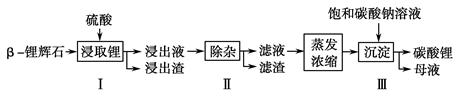
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g。
(1)步骤Ⅰ前,β锂辉石要粉碎成细颗粒的目的是________________________________________
______________________________________________________________________________。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO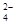 ,另含有Al3+、
,另含有Al3+、
Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有____________________________________________________________________________________。
(4)步骤Ⅲ中,生成沉淀的离子方程式为______________________________________________。
(5)从母液中可回收的主要物质是____________________________。
由短周期元素组成的化合物X是某抗酸药的有效成分。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝。
②Al3+在pH=5.0时沉淀完全;
Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
Ⅰ.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液。
Ⅱ.用铂丝蘸取少量Ⅰ中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。
(1)Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是________。
(2)由Ⅰ、Ⅱ判断X一定不含有的元素是磷、________。
(3)Ⅲ中生成B的离子方程式是____________________________。
(4)Ⅳ中B溶解的离子方程式是____________________ ______________。
(5)沉淀C的化学式是________。
(6)若上述n(A)∶n(B)∶n(C)=1∶1∶3,则X的化学式是________。
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
(1)A、B、C、D代表的物质分别为________、________、________、________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是
_________________________________________________________________________________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是________、________(填化学式);
(4)反应③产物中K的化学式为____________________________________;
(5)反应④的离子方程式为______________________________。
(届上海市六校高三第二次联考化学试卷)
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(一)用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+= 4Fe3++2H2O。FeSO4在水中的溶解度见图。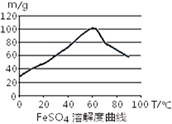
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液。此处:硫酸浓度应选择
| A.浓硫酸 | B.10moL/L硫酸 | C.3moL/L硫酸 | D.任意浓度硫酸; |
温度宜控制在______;加热的同时需适当补充水,原因是。反应中应保持n(Fe)/n(H2SO4)1(填“<”、“>”或“=”)。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得。过程中稀硫酸的作用是 。
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下: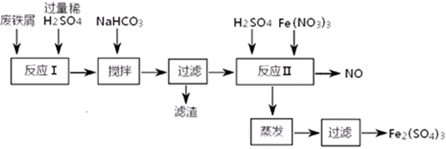
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
(4)加NaHCO3时,混合液pH值应控制在_______________________。
(5)反应Ⅱ中反应的离子方程式是:___________________。
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是________,气体X与NO配比的比例是_____________。
某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下: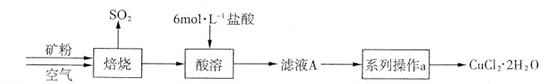
(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有、。
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是(填下列各项中序号)。
②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是(填下列各项中序号)。
a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为: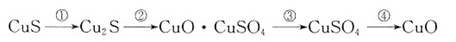
第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为。
②300~400oC范围内,固体质量明显增加的原因是,上图所示过程中,CuSO4固体能稳定存在的阶段是(填下列各项中序号)。
a.一阶段 b、二阶段 c、三阶段 d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。
a.装置组装完成后,应立即进行的一项操作是。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为溶液。
c.若原CuS矿样的质量为l0.0 g,在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.0 g,则原矿样中CuS的质量分数为。