(12分) 1 L某混合溶液中可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 |
Cl- Br- I‑ ClO‑ AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生 沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.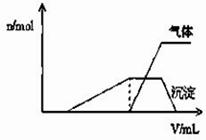
①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有 ,
③要确定其存在可补充做的实验是 ;
④肯定不存在的阴离子有 。
(2)经检测,该溶液中含有大量的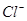 、
、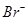 、
、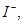 若向1 L该混合溶液中通入一定量的
若向1 L该混合溶液中通入一定量的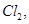 溶液中
溶液中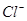 、
、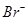 、
、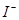 的物质的量与通入
的物质的量与通入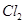 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8 L |
5.6L |
11.2L |
| n(Cl-) |
1.25mol |
1.5mol |
2mol |
| n(Br-) |
1.5mol |
1.4mol |
0.9mol |
| n(I-) |
a mol |
0 |
0 |
①当通入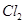 的体积为2.8 L时,溶液中发生反应的离子方程式为 。
的体积为2.8 L时,溶液中发生反应的离子方程式为 。
②原溶液中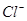 、
、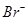 、
、 的物质的量浓度之比为 。
的物质的量浓度之比为 。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度 (mol·L-1) |
NaOH物质的量浓度 (mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2 ____(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是_________________。
(3)丙组实验结果分析,HA是酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=mol·L-1。写出该混合溶液中下列算式的精确结果(不需做近似计算)。
c(Na+)-c(A-)=mol·L-1c(OH-)-c(HA)=mol·L-1。
汽车内燃机工作时产生的高温会引起N2和O2 发生反应生成NO气体,其方程式为: N2 (g) +O2(g) 2NO (g),该反应是导致汽车尾气中含有NO的原因之一。
2NO (g),该反应是导致汽车尾气中含有NO的原因之一。
(1)右图表示在T1、T2两种不同温度下,一定量的NO发生反应:2NO(g) N2(g)+O2(g)。反应过程中N2的体积分数随时间变化的图像。升高温度,则反应N2 (g)+O2(g)
N2(g)+O2(g)。反应过程中N2的体积分数随时间变化的图像。升高温度,则反应N2 (g)+O2(g) 2NO (g)的平衡常数K将(填“增大”、“减小”或“不变”)。
2NO (g)的平衡常数K将(填“增大”、“减小”或“不变”)。
(2)2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则2000℃时反应N2 (g)+O2(g) 2NO (g)的平衡常数K的数值为。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为。
2NO (g)的平衡常数K的数值为。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为。
(3)研究发现,用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=―1160 kJ·mol-1
若1 mol CH4还原NO2至N2,整个过程中放出的热量为kJ。
在一定条件下,二氧化硫和氧气发生 如下反应:
2SO2(g)+ O2 (g) 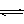 2SO3(g) (△H< 0)
2SO3(g) (△H< 0)
(1)降低温度,二氧化硫转化率_________,化学反应速率_ (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间____。
(3)据图判断,反应进行至20min时,曲线发生变化的原因是_____(用文字表达)
(4)10min到15min的曲线变化的原因可能是 __________________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。丙烷脱氢可得丙烯。
已知:C3H8(g) ="==" CH4(g)+HC≡CH(g)+H2(g)△H1="+156.6" kJ·mol-1
CH3CH=CH2(g)="==" CH4(g)+ HC≡CH(g )△H2="+32.4" kJ·mol-1
则C3H8(g) ="==" CH3CH=CH2(g)+H2(g)△H =kJ·mol-
(2)发射火箭时用肼( )作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知
)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知 完全发生上述反应放出
完全发生上述反应放出 的热量,热化学方程式是:
的热量,热化学方程式是:
。
反应A(g)+B(s) C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:(填增大,减小或不变)
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:(填增大,减小或不变)
(1) 升温___; (2) 增大压强____; (3) 增大容器容积 ____;
(4) 加正催化剂____; (5) 加入B____。