铁及其化合物在生产、生活中应用广泛。
(1)一定条件下,Fe与CO2可发生反应:
2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
该反应的平衡常数(K ) 随温度(T ) 升高而增大。
①该反应的平衡常数K=______。(填表达式)
②下列措施中,能使平衡时c(CO)/c(CO2) 增大的是 (填标号)。
| A.升高温度 | B.增大压强 |
| C.充入一定量CO | D.再加一些铁粉 |
(2)图1装置发生反应的离子方程式为 。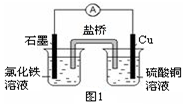
(3)图2装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
① 电源的M端为 极,甲烧杯中铁电极的电极反应为 。
② 乙烧杯中电解反应的化学方程式为 。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
某高分子材料的结构如右图,则其对应的单体的结构简式为:______________________,______________________。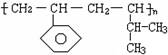
组成一种原电池如图所示。试回答下列问题(灯泡功率合适):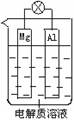
(1)电解质溶液为稀H2SO4时,灯泡______(填“亮”做①题,填“不亮”做②题)。
①若灯泡亮,则Mg电极上发生的反应为:____________________;
Al电极上发生的反应为:___________________________________。
②若灯泡不亮,其理由为:__________________________________。
(2)电解质溶液为NaOH溶液时,灯泡_____(填“亮”做①题,填“不亮”做②题)。
①若灯泡亮,则Al电极上发生的反应为:_____________________________。
②若灯泡不亮,其理由为:__________________________________________。
已知:
(1)傅瑞德尔一克拉福茨反应是在苯环上引入烷基的反应: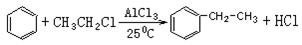
(2)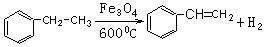
(3)烯烃与HX(X为原子或原子团)加成时,氢原子总是加在含氢较多的不饱和碳上,
即: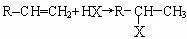
某同学给出了以乙烯、苯、食盐、水等为原料合成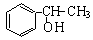 的部分流程图:
的部分流程图:
试回答下列问题:
(1)反应物A可由食盐、水经一系列反应获得,则反应物A为(填化学式),写出制备A 的化学方程式
(2)反应物B为(填化学式)
(3)反应Ⅰ~ Ⅳ中,属于加成反应的是(填序号)
(4)中间产物C的属于芳香烃的同分异构体有种(不包括自身),其中苯环上的一氯代物有2种的是(写结构简式)
(5)下列关于中间产物D的说法不正确的是
| A.既能使酸性高锰酸钾溶液褪色,也能使溴水褪色 |
| B.既能溶于水,也能溶于苯中 |
| C.1mol 中间产物D最多可与4mol H2完全反应 |
| D.所有原子不可能共平面 |
我国著名化学家傅鹰告诫我们“化学给人以知识,化学史给人以智慧。”回顾苯的结构的探索历程,曾有人提出两种立体结构: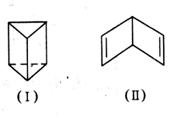 就上述两种立体结构回答下列有关问题:
就上述两种立体结构回答下列有关问题:
(1)若苯的结构为(Ⅰ),则在下列项目中它与苯的凯库勒式结构不同的是__________
A.一氯代物种数 B.二氯代物种数
C.与溴水的作用 D.燃烧时烟的浓度
(2)若苯的结构为(Ⅰ),则能解释下列说法中的
A.不能使酸性高锰酸钾溶液褪色 B.苯的邻位二氯代物没有同分异构体
C.在一定条件下能和氢气发生加成反应 D.和氯气在一定条件下发生取代反应
(3)若苯的结构为(Ⅱ),则苯(填“能”或“不能”)使溴水反应褪色?若能,请写
出一个可能反应的化学方程式;若认为不能,请说明原因。
丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为C4H8,A氢化(与H2加成)后得到2—甲基丙烷。完成下列填空:
(1)A的结构简式为
(2)A可以聚合,写出A的两种聚合方式(以反应方程式表示)
(3)将A通入溴的四氯化碳溶液后的现象,原因(用方程式表示)
(4)A与某烷发生烷基化反应生成分子式为C8H18的物质B,B的一卤代物只有4种,且碳链不对称。写出B的结构简式:
(5)在一定条件(与NBS作用)下,烯烃中与双键碳相邻碳原子上的一个氢原子可被溴原子取代。则分子式为C4H8的烯烃在一定条件(与NBS作用)下,得到的一溴代烯烃有种