下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( )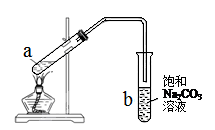
| A.试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 |
| B.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
| C.实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 |
| D.试管b中Na2CO3的作用是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中溶解度 |
能够快速、微量、精确的测定相对分子质量的物理方法是
| A.质谱 | B.红外光谱 | C.现代元素分析法 | D.核磁共振氢谱 |
下列符号表示的微粒,不属于官能团的是
| A.—OH | B.—COOH | C.—NO2 | D.Cl— |
下列物质的结构简式中,书写正确的是
| A.CH2CH2 | B.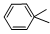 |
C.CH2 = C(CH3)2 | D.CH3COH |
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如下图,下列对该化合物叙述正确的是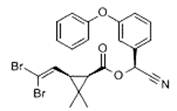
| A.属于芳香烃 | B.属于卤代烃 |
| C.属于高分子化合物 | D.属于有机化合物 |
下列解释实际应用的原理表达式中,不正确的是
A.用排饱和食盐水法收集 : :   |
B.热的纯碱溶液碱性增强: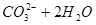   |
C.向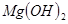 悬浊液中加入 悬浊液中加入 溶液: 溶液: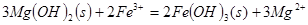 |
D.配制FeCl3溶液时为防止溶液浑浊常加入少量稀盐酸Fe3++3H2O Fe(OH)3+3H+, Fe(OH)3+3H+, |