(本题包括1小题,共12分)
27.四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2 Na2S4 + O2 + 2H2O =" 8S↓+" 4 NaOH。
【实验资料】
①四硫化钠(Na2S4)的相对分子质量为 ,其中硫元素的质量分数为 (结果精确到0.1%)。
②四硫化钠受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢。
③NaOH溶液呈碱性,可吸收硫化氢、二氧化碳、二氧化硫等酸性气体
④硫代硫酸钠(Na2S2O3)可溶于水,常温下与NaOH溶液不反应。
【实验过程】
①取碳酸钠、 硫粉混合后置于试管中,加热(如图1所示,夹持装置已略去),制得Na2S4,反应为4Na2CO3 + 12S + X  2 Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。
2 Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。 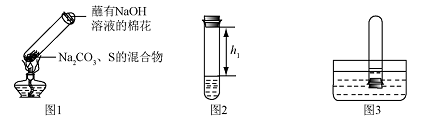
②冷却后,取下棉花,放置一段时间,再向该试管中加入10ml水,迅速塞紧橡胶塞,充分振荡,测量液面至橡胶塞下沿的距离,记录数据h1(如图2所示)
③将该试管插入水中(如图3所求),取下橡胶塞,观察到
,塞紧橡胶塞。将试管取出,倒过来,测量液面至橡胶塞下沿的距离,记录数据h2,理论上h1:h2=
④按照①~③再重复实验2次.3次实验数据如下表所示。
| |
第1次 |
第2次 |
第3次 |
| h1/cm |
11.2 |
11.4 |
11.6 |
| h2/cm |
8.9 |
9.1 |
9.2 |
【解释与结论】根据第1次实验数据,计算空气中氧气的体积分数为 (结果精确到0.1%)。
【反思与评价】(1)若实验过程②中,取下棉花后,未放置一段时间即进行后续操作,会影响测定结果,请说明有何影响,并阐述理由: 。
(2)若要保证实验的效果,至少需要生成四硫化钠(Na2S4)0.174g ,则理论上实验时至少取碳酸钠粉末 克?写出计算过程
小明在实验室发现一瓶未知浓度的氢氧化钡溶液,为方便以后使用,他对其浓度进行了测定.取20.0g此氢氧化钡溶液于烧杯中,逐滴滴加溶质质量分数为7.3%的稀盐酸,并随时对反应后的溶液用pH计(一种测定溶液pH的仪器)测定溶液的pH,所得数据如表:
| 加入稀盐酸的质量/g |
9.6 |
9.8 |
9.9 |
10.0 |
10.1 |
| 溶液的pH |
12.4 |
12.1 |
11.8 |
7.0 |
2.2 |
试回答:
(1)当滴加稀盐酸的质量为9.8g时,溶液中的溶质是________(29)_____________ ;
(2)计算所测氢氧化钡溶液中溶质的质量分数.(写出过程)______(30)_______
某碳酸钠样品中含少量氯化钠,化学兴趣小组的同学欲通过实验来测定样品中碳酸钠的质量分数。他们取5g该样品,配制成溶液,再向其中加入足量的氯化钙溶液(呈中性),测得加入氯化钙溶液的质量与产生沉淀的质量关系如图所示。请回答下列问题: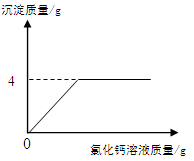
①该样品中碳酸钠的质量分数是多少?
(写出计算步骤,计算结果精确到0.1%)(7)
②如果反应开始前,向烧杯中滴加几滴无色酚酞试液,
在整个测定过程中可观察到的现象是:(8)。
下图是实验室制取氧气或二氧化碳时经常用到的装置,请回答有关问题。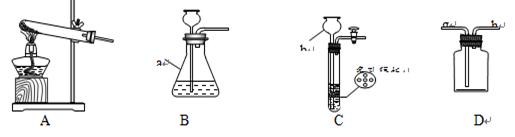
①写出仪器a、b的名称:a;b。
②装置C具有随时使反应发生或停止的特点,用该发生装置制取气体需满足的一般条件是。
③通过查阅资料得知:实验室用加热熟石灰和氯化铵的固体混合物制取氨气;氨气密度比空气小,极易溶于水,其水溶液显碱性。
(I)实验室制取氨气时选用的发生装置是(填编号),若用装置D收集氨气,进气口应为端(选填“g”或“h”)。
(II)若将收集满氨气的集气瓶倒扣在滴有无色酚酞试液的水中,观察到的现象是。
④实验室常用石灰石和稀盐酸制取CO2,某兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验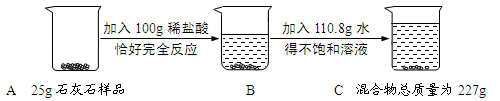
计算:(I)反应生成的二氧化碳的物质的量为mol。
(II)石灰石样品中碳酸钙的质量分数?(根据化学方程式列式计算)。
下面是实验室制取和收集气体的装置,根据所学知识回答下列问题: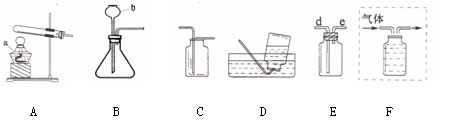
(1)写出仪器的名称:a;b
(2)从上图中选择装置制取并收集干燥的CO2,应选用图中的(填字母)。
(3)实验室若用装置E收集H2,气体应从导管的(填“d”或“e”)端进入。
(4)若制取的O2用B装置制取的反应原理,用F装置排水法收集,请将图F补画完整(直接在图中画出)。
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应)。随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示。请完成下列计算内容:(写出计算过程)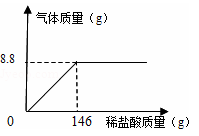
①样品中碳酸钙的质量分数是多少?
②所用稀盐酸溶质的质量分数是多少?
欲测定某锌﹣铜合金中铜的质量分数,进行如下实验:取合金样品10克放入烧杯中,将60克稀硫酸分三次加入,充分反应后,测得生成气体的质量如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 加入稀硫酸质量/g |
20 |
20 |
20 |
| 生成气体质量/g |
0.08 |
m |
0.04 |
请回答下列问题并计算:
(1)第二次实验时生成气体质量m= _________ 克;
(2)计算该合金样品中铜的质量分数.