下面是实验室制取和收集气体的装置,根据所学知识回答下列问题: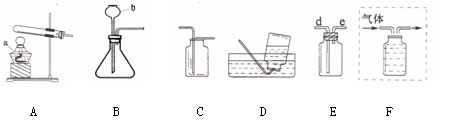
(1)写出仪器的名称:a ;b
(2)从上图中选择装置制取并收集干燥的CO2,应选用图中的 (填字母)。
(3)实验室若用装置E收集H2,气体应从导管的 (填“d”或“e”)端进入。
(4)若制取的O2用B装置制取的反应原理 ,用F装置排水法收集,请将图F补画完整(直接在图中画出)。
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应)。随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示。请完成下列计算内容:(写出计算过程)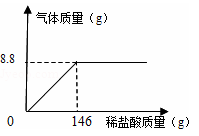
①样品中碳酸钙的质量分数是多少?
②所用稀盐酸溶质的质量分数是多少?
环保部门对某工厂的废水进行抽样分析,结果表明废水中含少量硫酸。取一定量废水用质量分数为2%的氢氧化钠溶液中和(已知废水中的其它成分不与氢氧化钠反应),至pH = 7时,消耗氢氧化钠溶液的质量为40g,同时测得反应后溶液质量为138g。请计算该工厂排放的废水中硫酸的质量分数。
小丽同学在某化工厂参加社会实践,与技术员一起分析由Na2CO3和NaCl组成的样品中NaCl的质量分数。现取15g该固体样品,全部溶于200mL水中,向所得到的混合溶液中逐滴滴入溶质质量分数为7.3%的稀盐酸,记录了如下图所示的曲线关系。(水的密度为1g/mL,计算结果精确到0.1%)
(1)当Na2CO3与稀盐酸恰好完全反应时,消耗7.3%的稀盐酸的质量是g;
(2)样品中NaCl的质量分数是多少?
(3)计算Na2CO3与稀盐酸恰好完全反应时,所得溶液的溶质质量分数。
某化学研究小组对当地的石灰石样品进行了研究。称取石灰石样品16g,把80g稀盐酸分四次加入样品中,测得实验数据见下表(假设石灰石样品中杂质不溶于水、不与盐酸反应,二氧化碳不溶解)。
| 实验序号 |
加入稀盐酸的质量/g |
剩余固体物质的质量/g |
| 第1次 |
20 |
11 |
| 第2次 |
20 |
6 |
| 第3次 |
20 |
3.2 |
| 第4次 |
20 |
m |
(1)第4次剩余固体物质的质量m=g
(2)石灰石样品中CaCO3的质量分数为。
(3)计算稀盐酸的溶质质量分数。
市场上有一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK) ,在去年我国南方地区抗击暴风雪中融雪剂发挥了一定的作用。请回答:
(1)醋酸钾中C、H、O元素的质量比为;
(2)392g醋酸钾中含有_________g碳元素;
(3)醋酸钾中钾元素的质量分数为(保留一位小数)
取盐酸与氯化钙的混合溶液11.88kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液。所得溶液pH与加入的碳酸钠溶液的质量关系如右图所示
(1)通过右图可知,当碳酸钠溶液质量加到kg时,溶液恰好完全反应 (盐酸与氯化钙的混合溶液完全转化成氯化钠溶液)。
(2) 溶液恰好完全反应时所得溶液中所含溶质氯化钠质量?